1. Las joyas del serpentario
A pesar de la idea generalizada de que las serpientes son animales comunes en las zonas naturales y rurales, lo cierto es que son reptiles esquivos, crípticos y poco comunes, más aún en los trópicos. Encontrar serpientes en ecosistemas tropicales suele ser una tarea difícil. La mayoría de las serpientes viven en hábitats ocultos, aislados y de difícil acceso (p. ej., la selva hiperhúmeda del Chocó y la selva amazónica). Además, debido al conflicto armado en Colombia, algunas regiones del país han sido históricamente inaccesibles o altamente riesgosas para los investigadores
[1,2].
Lograr un muestreo robusto de serpientes tropicales es siempre un gran desafío, y más aún si el objetivo es capturar especies venenosas para establecer un programa para la producción de antiofídicos a gran escala. Históricamente, investigadores experimentados han empleado diseños de muestreo intensivos en áreas definidas en hábitats tropicales. No obstante, sus resultados han demostrado que, aunque se invierta un enorme esfuerzo de muestreo, no se logra obtener una representatividad completa de la comunidad de serpientes
[3–5].
Por lo tanto, la adquisición de serpientes vivas para la producción de antiofídicos, que incluya todas las serpientes de importancia médica con una representatividad geográfica aceptable, exige desafíos tales como: (1) construir una red sólida de colaboradores que incluya investigadores, autoridades gubernamentales y aliados no gubernamentales; (2) invertir un gran esfuerzo de muestreo realizando muestreos intensivos de serpientes; y (3) ser paciente y tener una alta tolerancia a la frustración debido a la naturaleza evasiva y críptica de las serpientes. En consecuencia, todas las serpientes para la producción de antiofídicos recolectadas y alojadas a lo largo de décadas en el Instituto Nacional de Salud (INS) de Colombia son joyas que merecen ser muy bien cuidadas y mantenidas con esmero. Este capítulo resume la historia de las lecciones aprendidas sobre las serpientes venenosas alojadas en el serpentario del INS, así como la información más destacable sobre estas joyas del serpentario.
1.1. Riqueza y representatividad taxonómica de las serpientes
Históricamente, el serpentario del INS ha albergado al menos 608 ejemplares de serpientes, según los registros clínicos disponibles de 1990 a 2021. Sin embargo, este número dista mucho de ser representativo de la verdadera historia del serpentario porque durante el período 1965-1985 cuando estaba ubicado en el municipio de Armero (departamento de Tolima), se albergaron alrededor de 1.000 ejemplares (com pers. Juan Manuel Renjifo,
ver Capítulo 7). Sin embargo, los registros de estos especímenes son escasos debido a que las historias clínicas estandarizadas se establecieron a partir del año 2000 (Tabla 1).
Durante la etapa inicial del serpentario en Armero, la población en cautiverio estaba conformada principalmente por individuos de tres especies:
Crotalus durissus (cascabel),
Bothrops asper (Talla X) y
B. atrox (mapanare). Después de la reubicación del serpentario de Armero (ver Capítulo 7) a lo largo del tiempo, la riqueza y abundancia de especies del serpentario crecieron gradualmente, agregando ocasionalmente víboras como
Bothriechis schlegelii (víbora de pestañas), y
Lachesis muta (verrugoso), pero manteniendo a
Crotalus durissus,
Bothrops asper y
B. atrox como el núcleo de especies para la producción de antiofídicos. Desde 2012 a la actualidad, se logró un notorio aumento en la abundancia y riqueza de especies de serpientes colombianas de importancia médica albergadas en el serpentario (Tabla 1). Asimismo, se logró incluir a la población general del serpentario serpientes coral (Micrurus spp.), consiguiendo que su representatividad en el serpentario se volviera permanente. Estos logros fortalecieron la producción nacional de antiofídicos, así como el establecimiento de un programa intensivo de cautiverio de serpientes a gran escala para la producción de suero anticoral
[6].
Tabla 1. Número de serpientes venenosas alojadas históricamente en el serpentario del Instituto Nacional de Salud de Colombia.
| Periodo |
Familia Elapidae (Corales) |
Familia Viperidae (Víboras) |
Ejemplares totales |
| 1965-1985 |
0 |
~1.000 |
~1.000 |
| 1990-2011 |
0 |
49 |
49 |
| 2012-2021 |
181 |
378 |
559 |
| Total |
181 |
427 |
608 |
A lo largo de la última década, el serpentario ha mantenido siete de los ocho géneros de serpientes de importancia médica en el país: especies de víboras de los géneros
Bothriechis,
Bothrocophias,
Bothrops,
Crotalus,
Porthidium y
Lachesis; y varias especies de corales del género
Micrurus. La serpiente marina de vientre amarillo
Hydrophis platurus ha sido la única especie ausente en toda la historia del serpentario (Figura 1).
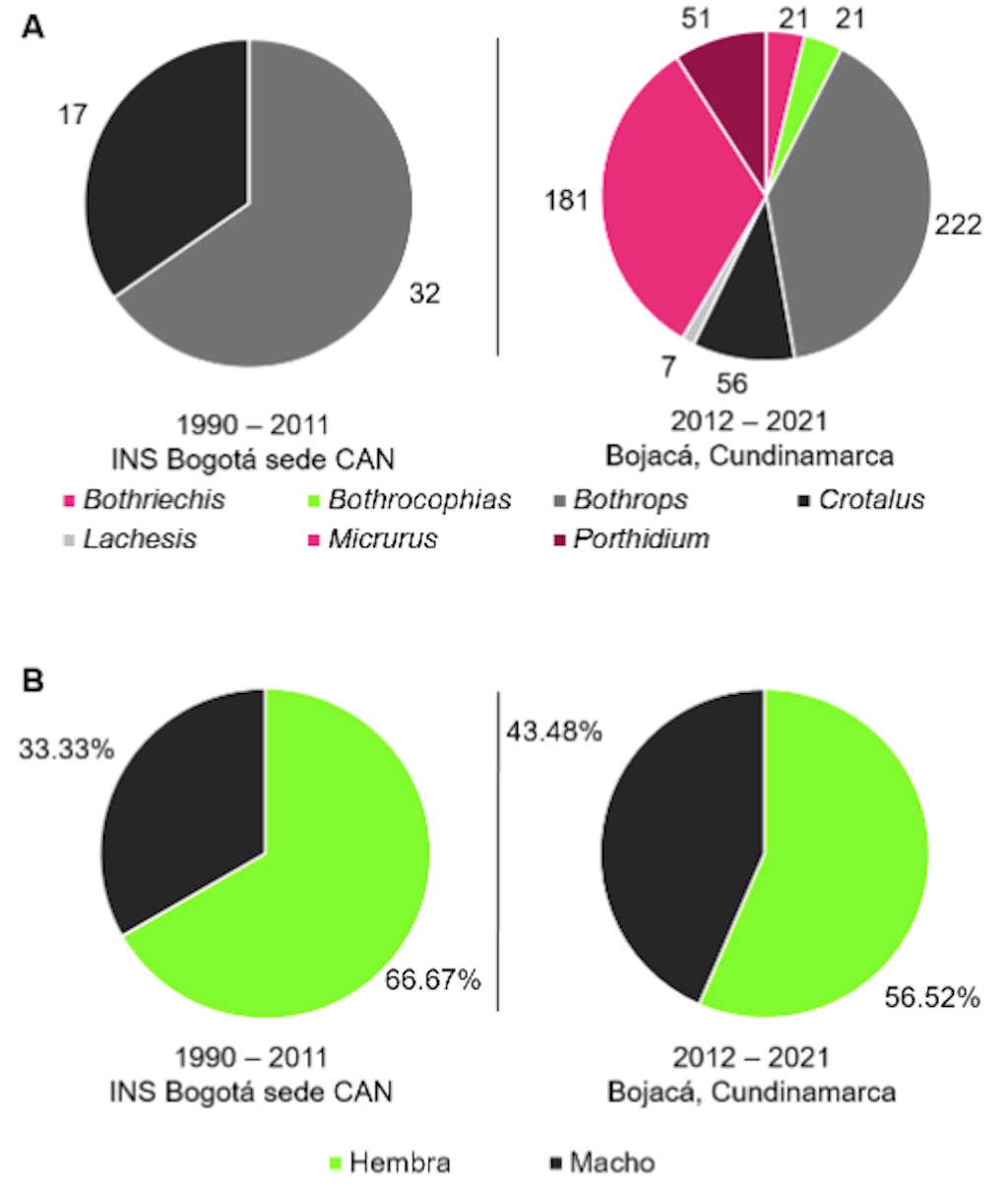
Figura 1. Número de serpientes por género y porcentajes por sexo alojadas en el serpentario del Instituto Nacional de Salud de Colombia. (A) izquierda, número de serpientes por género en el período 1990 – 2011; (A) derecha, número de serpientes por género en el período 2012 - 2021. (B) izquierda, porcentaje por sexo de serpientes durante el período 1990 – 2011; (B) derecha, porcentaje por sexo de serpientes durante el periodo 2012 - 2021.
Curiosamente, cuando se revisó la proporción histórica de sexos de las serpientes albergadas en el serpentario, se observó un sesgo en su proporción, el porcentaje de hembras fue mayor que el de machos, independientemente del año o período histórico evaluado (Figura 1). La mayoría de las serpientes alojadas en el serpentario provienen de encuentros ocasionales o búsquedas activas de serpientes. Por lo tanto, existen numerosas explicaciones para el sesgo observado, como lo son: sesgo por tipo de muestreo, proporciones de sexos sesgadas por la especie o población, mortalidad diferencial, inmigración y emigración diferencial, y madurez diferencial de los sexos entre y dentro de las especies
[7]. Debido a la carencia de estudios sobre la historia natural de la mayoría de las especies de importancia médica en Colombia, así como a la falta de conocimiento sobre las interacciones en el conflicto entre humanos y serpientes, no podemos explicar las razones de este resultado, ni indicar si alguno o varios de los factores anteriormente nombrados direccionan este sesgo.
Los enormes esfuerzos invertidos por el gobierno colombiano, liderado por el INS en la recolección de especímenes de serpientes de importancia médica durante la última década, con el fin de mejorar la capacidad de producción y neutralización de sus propios antiofídicos polivalentes, han tenido un enorme impacto en la riqueza de especies y la representatividad de las serpientes alojadas en el serpentario. Antes de 2011, la riqueza acumulada era menor a cuatro especies, pero durante el periodo 2012 a 2021 la riqueza acumulada de especies mostró un rápido crecimiento, alcanzando un total de 25 especies de serpientes. Estas especies representaron el 48% del total de serpientes de importancia médica en el país, y abarcan el 100% de las principales especies de serpientes venenosas que causan envenenamiento en Colombia (Figura 2).
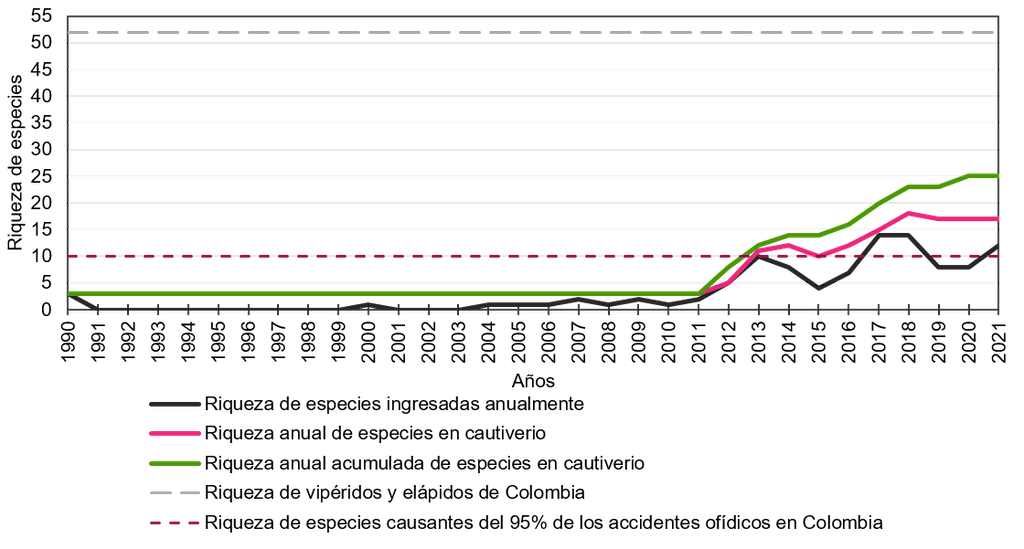
Figura 2. Riqueza anual de especies de vipéridos y elápidos alojados históricamente en el serpentario del Instituto Nacional de Salud de Colombia.
Asimismo, estos esfuerzos contribuyeron a obtener un mayor número de ejemplares y especies de serpientes alojadas en el serpentario por unidad geográfica y política durante el periodo 2012-2021 (Figura 3). Por lo tanto, se fortaleció el banco de venenos utilizados para la producción e investigación de antiofídicos, aumentando el número de venenos por especie, población y ecorregión. En particular, en la última década la representatividad por unidad política creció de 12 a 23 departamentos, de tres a cinco ecorregiones, con un promedio de 3,9 a 22,6 serpientes por departamento (Figura 3).
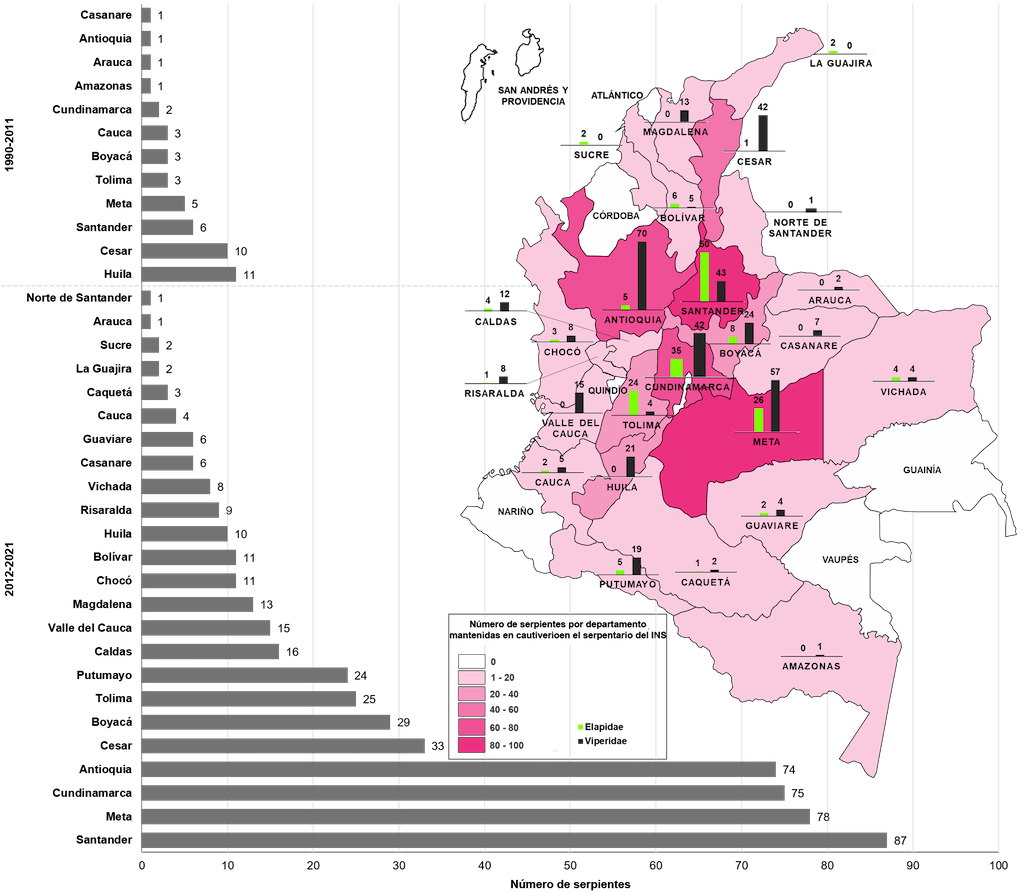
Figura 3. Gráfico de barras que muestra la representación política histórica de las serpientes en cautiverio en el serpentario del Instituto Nacional de Salud (INS). Mapa que muestra la representación geográfica histórica de las serpientes mantenidas en cautiverio en el serpentario del INS.
A pesar de estos enormes esfuerzos, aún existe una escaza representatividad geográfica, así como un bajo número de ejemplares por especie en ecorregiones como la Amazonía, el Pacífico y el Caribe (en particular en la alta Guajira). Estos vacíos se producen por los altos costos que implica realizar búsquedas de serpientes en ecosistemas aislados, no visitados o de difícil acceso como el bosque seco xerófilo (departamento de La Guajira), el bosque hiperhúmedo de la selva chocoana, las tierras bajas del norte de Amazonía, las tierras altas del Pacífico y las laderas orientales de las montañas de los Andes que abarcan los bosques montanos húmedos y bosques montanos nublados.
Además, cuando las autoridades ambientales u organizaciones aliadas tienen serpientes venenosas para donar al serpentario, existen serias limitaciones para su entrega o traslado desde su lugar origen porque las empresas de transporte y mensajería en Colombia no cuentan con los procedimientos y capacidades para transportar este tipo de carga. Además, el conflicto armado colombiano ha restringido la libre circulación en zonas naturales y rurales, lo que hace que sea riesgoso obtener serpientes para la producción de antiofídico en varios municipios del país
[2].
Sin embargo, la historia reciente del serpentario mostró que la adquisición de serpientes en la última década ha fortalecido notablemente la capacidad de producción y neutralización de los antiofídicos, mostrando una tendencia creciente para superar la escasez del pasado (ver Capítulo 6), así como para consolidar un sólido programa de cautiverio de serpientes para la producción de antiofídicos.
2. Sobreviviendo al encierro
Uno de los objetivos más desafiantes de cualquier serpentario es mantener vivas a las serpientes el mayor tiempo posible. Sin embargo, establecer un programa intensivo de cautiverio de serpientes a gran escala para la producción de antiofídicos, es sustancialmente diferente, a instaurar un programa de exhibición o de estudios biológicos. En este entorno de cautiverio se deben implementar numerosos protocolos estrictos y estandarizados de bienestar animal que propenden por extender lo más posible la expectativa de vida de las serpientes empleadas para la producción de antiofídicos.
[8]. La supervivencia de las serpientes en cautiverio está asociada a múltiples factores como: las condiciones iniciales de la serpiente cuando llega al serpentario, el ambiente de cautiverio, la etapa de desarrollo de la serpiente, el sexo, la condición corporal, el estado de salud, la región de origen, la alimentación, así como la frecuencia y protocolos de manipulación en el laboratorio.
[8].
Experiencias previas en todo el mundo han demostrado que a pesar de una cuidadosa estandarización y combinación adecuada de variables ambientales (p. ej., temperatura, humedad, luz, frecuencia de alimentación, espacio físico), así como estrictas condiciones sanitarias y cuidados veterinarios, no es posible garantizar que las serpientes se adapten al cautiverio
[8–13]. Alrededor del 90% de los reptiles capturados en la naturaleza mueren en el primer año de cautiverio debido a un trauma físico previo a la captura o porque sus cuidadores no pueden satisfacer sus complejas necesidades de hábitat y nutrición
[14].
El síndrome de mal adaptación, o incapacidad de la serpiente para adaptarse al cautiverio, es la principal fuente de mortalidad en los serpentarios a nivel mundial debido a los efectos patológicos del estrés
[8,12,13]. El cautiverio está asociado a factores estresantes que pueden inducir cambios fisiológicos y comportamentales crónicos y constantes en las serpientes, provocando respuestas y niveles no adaptativos de secreción de glucocorticoides que perturban crónicamente sus actividades normales, lo que lleva a un deterioro del bienestar de las serpientes
[13]. Por lo tanto, comprender los factores que pueden afectar la supervivencia de las serpientes en cautiverio es fundamental para lograr la implementación exitosa de un programa intensivo de cautiverio de serpientes para la producción de antiofídicos a gran escala
[8].
Actualmente en Colombia existe solo un estudio que explora de manera cualitativa las condiciones de mantenimiento y los factores que afectan la supervivencia en cautiverio de las serpientes empleadas para la producción de antiofídicos
[11]. Por lo tanto, se desconocen los patrones de supervivencia en cautiverio de las poblaciones de serpientes colombianas. Con base en las historias clínicas de las serpientes alojadas en el serpentario del INS durante el período 2012-2021, esta sección proporciona una perspectiva amplia de los factores intrínsecos y extrínsecos que podrían afectar la supervivencia de las serpientes de importancia médica mantenidas en cautiverio. Además, se describen los principales hallazgos clínicos, patologías y rasgos de historia natural observados en las serpientes colombianas de importancia médica en cautiverio.
2.1. Tasas de supervivencia
El momento en que muere una serpiente se convierte en uno de los eventos más lamentables en un serpentario destinado a la producción de antiofídicos. Por lo tanto, comprender cómo varían las tasas de supervivencia de la población de serpientes en cautiverio, así como cuáles variables intrínsecas o extrínsecas se correlacionan con el tiempo de supervivencia de la serpiente, es imperativo. A lo largo de la historia del serpentario del INS, existieron tres etapas con diferentes esquemas de mantenimiento. Durante el período 1965-1985 las serpientes se mantuvieron en un serpentario semi-intensivo en el municipio de Armero (un serpentario que utiliza un único recinto para toda la población de serpientes, proporcionando alojamiento y refugio, pero careciendo de encierros individuales aislados y protocolos sanitarios estandarizados) el cual emulaba el esquema tradicional de cautiverio empleado por el Instituto brasilero Butantan durante la primera mitad del siglo XX
[15].
Existen pocos registros documentados sobre las tasas de supervivencia de las serpientes durante este período, pero según el personal de esa época, las búsquedas de serpientes en ecosistemas naturales eran frecuentes debido a las bajas tasas de supervivencia en cautiverio (com pers. Juan Manuel Renjifo,
ver Capítulo 7); las cuales eran similares a la mortalidad reportada por el Butantan durante el período de manejo semintensivo de su serpentario (entre el 92% - 98% anual)
[15].
Después de la tragedia de Armero en 1985, cuando la erupción del Nevado del Ruiz generó el derretimiento de los glaciares creando enorme alud de tierra que sepultó este municipio, entre diciembre de 1985 y hasta diciembre de 2011, el serpentario del INS funcionó en Bogotá (ver Capítulo 7). No obstante, con el tiempo, las instalaciones en Bogotá presentaron limitaciones técnicas y operativas, así como deficiencias para establecer un programa adecuado de cautiverio intensivo de serpientes para la producción de antiofídicos a gran escala. Por lo tanto, desde 2012, el serpentario del INS funciona en la Hacienda Galindo en el municipio de Bojacá, Cundinamarca.
Dado que existen registros disponibles desde 1990, se logró estimar las tasas de supervivencia de serpientes en cautiverio en Bogotá y Bojacá, así como de la población de serpientes trasladadas de Bogotá al serpentario de Bojacá. Sin embargo, las comparaciones de las tasas de supervivencia entre las instalaciones del INS solo consideran a
Crotalus durissus,
Bothrops asper y
B. atrox ya que eran únicas poblaciones de serpientes alojadas en las instalaciones de Bogotá durante el período 1990-2011.
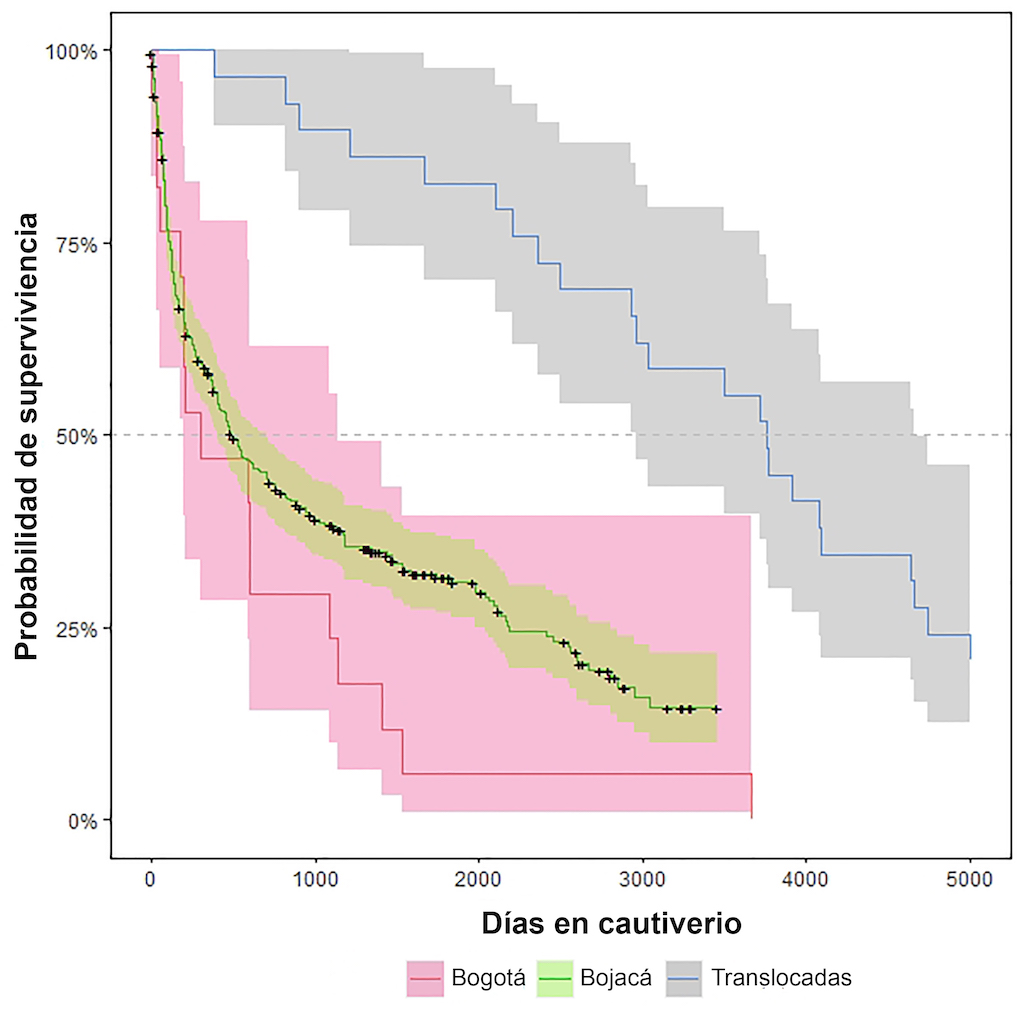
Figura 4. Tiempo medio de supervivencia de las serpientes alojadas en las instalaciones del serpentario del INS de Bogotá, Bojacá, y de las serpientes traslocadas entre instalaciones.
La decisión histórica de trasladar el serpentario de Bogotá a Bojacá claramente fue exitosa, representando una victoria temprana para el establecimiento adecuado de un programa de producción de antiofídicos a gran escala. Las tasas de supervivencia fueron significativamente diferentes entre las dos instalaciones del serpentario del INS, así como en la población de serpientes traslocadas (X2 = 31,1; gl = 2; P < 0,0001), mostrando un notable aumento de 260 días en la vida media en la población de Bojacá, permitiendo al menos cuatro a seis ordeños de venenos por espécimen. Curiosamente, las serpientes traslocadas de Bogotá a Bojacá exhibieron un gran aumento en la esperanza de vida, con un tiempo de supervivencia medio de 3.870 días (Figura 4). La mayoría de las serpientes traslocadas fueron especímenes de
Crotalus durissus (cascabel suramericano), indicando que las poblaciones colombianas de esta especie bajo condiciones de cautiverio presentan tasas de supervivencia con un decrecimiento bajo y constante, y una alta tasa de supervivencia una vez superado el período de adaptación al cautiverio (ver detalle más adelante).
Durante la última década, las tasas de supervivencia de las serpientes en cautiverio del serpentario del INS mostraron variabilidad según su origen, familia, género y especie. En general, la mediana del tiempo de supervivencia, que representa el tiempo en el que ha fallecido el 50% de la población de serpientes en cautiverio, fue de 580 días (Figura 5A). Esto significa que, durante la última década, cada 1,6 años se produjo un recambio poblacional. También se observaron diferencias en el tiempo medio de supervivencia en las serpientes en cautiverio según su ecorregión (X2 = 30,9; gl= 5; P <0,0001). Estas diferencias significativas eran esperadas debido a la compleja geografía y topografía colombiana que configura claramente ecorregiones con biotas y climas específicos.
[16]. Además, los cambios climáticos y biofísicos tienen impactos en el desempeño general de las poblaciones de serpientes silvestres y cautivas, particularmente en las tasas de supervivencia
[13,17].
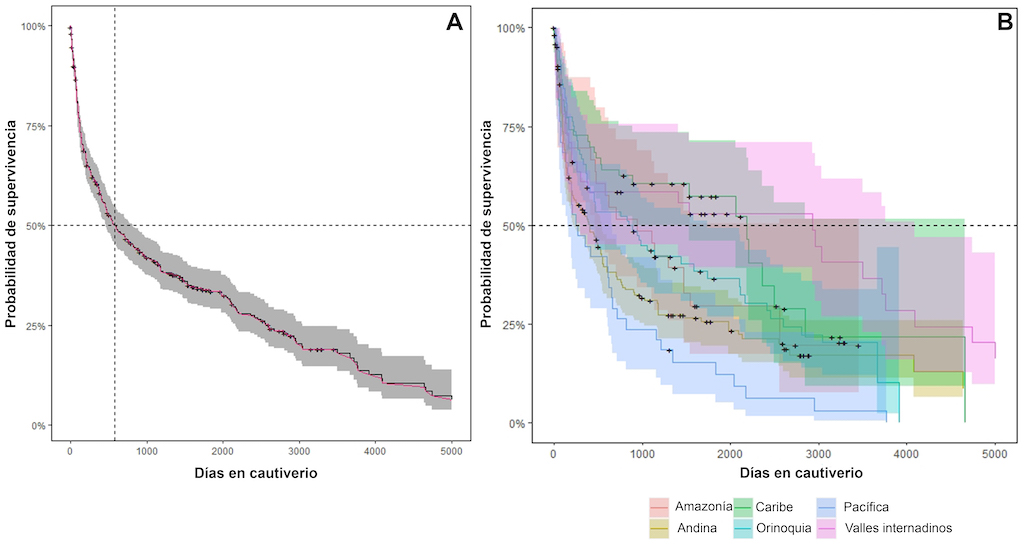
Figura 5. Tiempo medio de supervivencia de las serpientes alojadas en el serpentario del Instituto Nacional de Salud durante el periodo 2010-2021. (A) Tiempo medio de supervivencia de toda la población de serpientes. (B) Tiempo medio de supervivencia de toda la población de serpientes por ecorregión.
Las especies provenientes de ambientes altamente húmedos, como las ecorregiones del Pacífico, Amazonía y Andina tienden a mostrar un mayor síndrome de mal adaptación que resulta en tiempos de supervivencia medios más cortos en comparación con las especies de ambientes secos o moderadamente húmedos, como el Caribe, la Orinoquia y los valles interandinos (Figura 5B). Este síndrome de mal adaptación o estrés fisiológico ocurre principalmente porque las condiciones ambientales del serpentario son homogéneas para todas las especies, independientemente de su ecorregión de origen (temperatura: 26±0,2 °C; humedad relativa (Hr): 65±5), aunque con cambios menores a lo largo del recinto del serpentario (variación vertical ~ 3,52 °C/ 5,65 h; variación horizontal ~ 1,52 °C/ 2,65 h).
Por lo tanto, estas condiciones pueden causar un estrés significativo para las serpientes que provienen de ambientes muy húmedos o secos, reduciendo su probabilidad de supervivencia. En particular, algunas patologías como disecdisis incompleta (patrón anormal de muda de piel), micosis (infección por hongos), dermatitis (irritación de la piel) y deshidratación están asociadas con el síndrome de mal adaptación en las serpientes debido a ambientes muy húmedos,
[18,19]. Alrededor del 50% de las serpientes alojadas en el serpentario del INS, independientemente de su origen, tienen una mediana de supervivencia de más de 1 año y un promedio de 2,96 años para población general, lo que indica que las serpientes en cautiverio para la producción de antiofídicos durante la última década se han mantenido en buenas condiciones de cautiverio (Tabla 2).
Tabla 2. Tiempo medio de supervivencia y esperanza de vida observados durante el período 2010-2021 en serpientes cautivas para la producción de antiofídico alojadas en el serpentario del INS.
| Grupo |
N |
Tiempo medio de supervivencia (días) |
ICI (95%) |
ICS (95%) |
Expectativa de vida (años) |
| Ecorregiones |
|
|
|
|
|
| Amazonia |
33 |
963 |
0,34 |
0,69 |
2,83 (0,01-9,61) |
| Andes |
177 |
398 |
0,40 |
0,60 |
2,11 (0,01-14,45) |
| Caribe |
73 |
2.198 |
0,39 |
0,70 |
2,75 (0-12,94) |
| Orinoquia |
86 |
851 |
0,39 |
0,60 |
2,98 (0,01-10,87) |
| Pacífico |
38 |
260 |
0,36 |
0,69 |
1,85 (0,01-10,48) |
| Valles interandinos |
42 |
2.930 |
0,30 |
0,60 |
4,83 (0,01-15,5) |
| Familias |
|
|
|
|
|
| Elapidae |
153 |
192 |
0,42 |
0,59 |
1,44 (0,01-8,01) |
| Viperidae |
308 |
1.136 |
0,45 |
0,56 |
3,25 (0-15,55) |
| Géneros de vipéridos |
|
|
|
|
|
| Bothriechis |
12 |
* |
* |
* |
3,28 (0,36-4,94) |
| Bothrocophias |
8 |
* |
* |
* |
1,09 (0.02-4,62) |
| Bothrops |
190 |
1.174 |
0,45 |
0,60 |
3,17 (0.01-14,03) |
| Crotalus |
54 |
3.499 |
0,36 |
0,70 |
5,21 (0-15,55) |
| Lachesis |
6 |
* |
* |
* |
0,75 (0.01-2,93) |
| Porthidium |
38 |
198 |
0,45 |
0,70 |
1,70 (0.01-7,12) |
| Especies de vipéridos |
|
|
|
|
|
|
Bothriechis schlegelii |
12 |
* |
* |
* |
3,24 (0,36-4,87) |
|
Bothrocophias tulitoi |
8 |
* |
* |
* |
1,07 (0,02-4,56) |
|
Bothrops asper |
100 |
* |
|
|
2,64 (0,01-10,33) |
|
Bothrops atrox |
85 |
2.103 |
0,40 |
|
3,77 (0,02-13,84) |
|
Bothrops bilineatus |
1 |
* |
* |
* |
4,21 |
|
Bothrops oligobalius |
1 |
* |
* |
* |
3,76 |
|
Bothrops punctatus |
1 |
* |
* |
* |
0,18 |
|
Bothrops venezuelensis |
2 |
* |
* |
* |
0,52 (0,24-8,0) |
|
Crotalus durissus |
54 |
3.499 |
0,36 |
0,70 |
5,21 (0-15,55) |
|
Lachesis acrochorda |
3 |
* |
* |
* |
0,51 (0,02-1,40) |
|
Lachesis muta |
3 |
* |
* |
* |
0,98 (0,01-2,88) |
|
Porthidium lansbergii |
38 |
198 |
0,45 |
0,70 |
1,70 (0,01-7,12) |
| Especies de Micrurus |
|
|
|
|
|
|
M. camilae |
1 |
* |
* |
* |
0,55 |
|
M. dissoleucus |
4 |
* |
* |
* |
2,41 (0,18-4,91) |
| M. dumerilii |
70 |
199 |
0,40 |
0,65 |
1,69 (0,01-7,77) |
|
M. filiformis |
1 |
* |
* |
* |
0,17 |
|
M. helleri |
9 |
* |
* |
* |
1,66 (0,06-3,18) |
|
M. hemprichii |
2 |
* |
* |
* |
0,90 (0,10-1,70) |
| M. cf lemniscatus |
4 |
* |
* |
* |
4,08 (3,53-4,38) |
|
M. medemi |
11 |
* |
* |
* |
1,30 (0,09-2,70) |
|
M. mipartitus |
35 |
103 |
0.41 |
0.75 |
0,72 (0,01-4,71) |
|
M. multiscutatus |
1 |
* |
* |
* |
0,01 |
|
M. nattereri |
1 |
* |
* |
* |
0,38 |
|
M. sangilensis |
4 |
* |
* |
* |
2,37 (0,12-7,90) |
|
M. obscurus |
1 |
* |
* |
* |
0,04 |
|
M. surinamensis |
9 |
* |
* |
* |
0,65 (0,24-1,28) |
N: Tamaño de la muestra. ICI. Intervalo de confianza inferior. ICS: Intervalo de confianza superior. *: Datos excluidos debido al pequeño tamaño de la muestra.
Las diferencias en el tiempo de supervivencia medio entre elápidos y vipéridos son notables (X2 = 36,6; gl = 1; P <0,0001), mostrando que las especies de elápidos exhiben tiempos de supervivencia medios más bajos que las especies vipéridos (Tabla 2). Por lo tanto, las corales son más propensas a mostrar síndromes de mala adaptación que las víboras (Figura 6A). Comparativamente, las especies de elápidos requieren cuidados y condiciones ambientales más especializadas que los vipéridos, en aspectos como tipos de sustratos, presas naturales, técnicas de alimentación, horarios de ordeño y técnicas de manejo.
[9–11,20–24]. Además, la falta de complejidad ambiental o ambientes enriquecidos se han propuesto como factores estresantes que impactan directamente las tasas de supervivencia de las serpientes en cautiverio
[9].
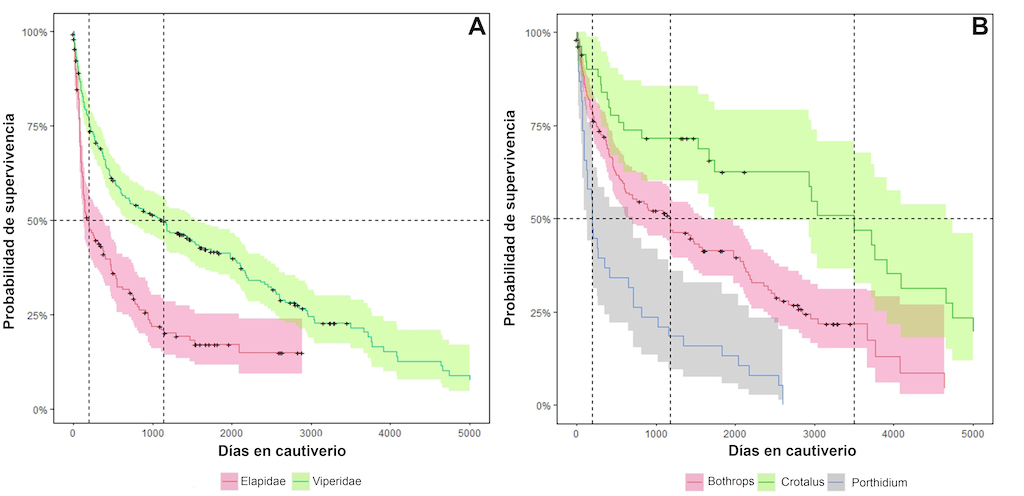
Figura 6. Tiempos medios de supervivencia. (A) Comparación entre las dos principales familias de serpientes de importancia médica alojadas en el serpentario del Instituto Nacional de Salud durante el período 2010-2021. (B) Comparaciones entre géneros de vipéridos alojados en el serpentario del Instituto Nacional de Salud durante el periodo 2010-2021.
Sin embargo, el tiempo medio de supervivencia observado en las especies de corales (género
Micrurus) alojadas en el serpentario del INS supera lo reportado en otros serpentarios para la producción de antiofídicos
[23,25], indicando que el enriquecimiento ambiental realizado proporciona un bienestar adecuado para estas serpientes (ver detalle más adelante). Además, no se observaron diferencias significativas en el tiempo medio de supervivencia entre las especies de
Micrurus (X2 = 3,0; gl= 1; P= 0,08). La expectativa de vida entre
Micrurus dumerilii y
M. mipartitus fueron muy similares variando en 91 días entre estas especies (Figura 7A).
En contraste, las especies de vipéridos colombianos parecen tener una mayor capacidad de adaptación al cautiverio, no obstante, muestran diferencias significativas entre géneros (X2 = 47,8; gl= 2; P <0,0001).
Crotalus durissus exhibe la expectativa de vida y el tiempo medio de supervivencia más extenso, seguidos por las especies de los géneros
Bothrops y
Porthidium (Figura 6B). Asimismo, también se observan diferencias significativas entre las especies de víboras (X2= 54,2; gl= 3; P <0,0001), exhibiendo un perfil de supervivencia distintivo, así como un tiempo medio de supervivencia específico (Figura 7B).
Crotalus durissus muestra la supervivencia media más alta (3.499 días), seguido de
Bothrops atrox (2.103 días),
B. asper (891 días) y
Porthidium lansbergii (198 días).
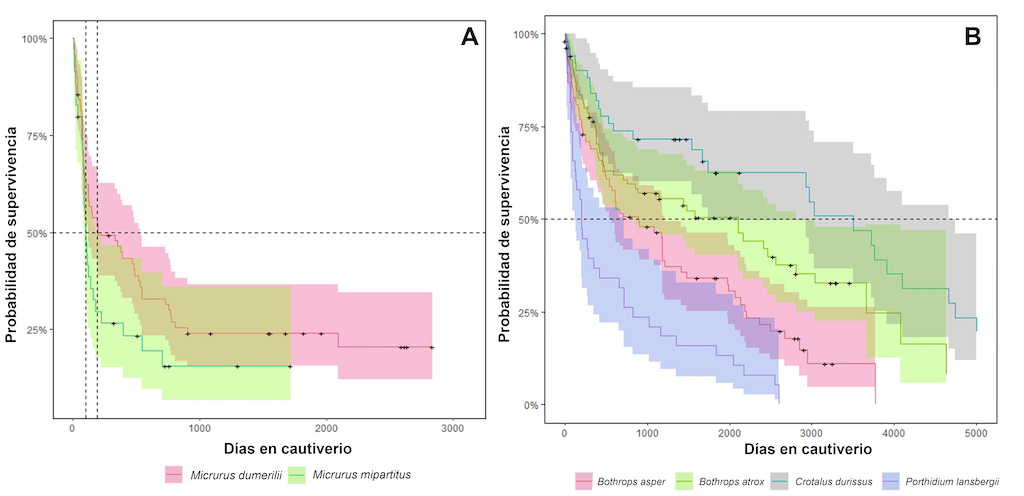
Figura 7. Tiempo medio de supervivencia. (A) Comparación entre las dos principales especies de elápidos de importancia médica alojadas en el serpentario del Instituto Nacional de Salud durante el período 2010-2021. (B) Comparaciones entre las principales especies de vipéridos de importancia médica alojadas en el serpentario del Instituto Nacional de Salud durante el periodo 2010-2021.
De hecho, las especies de los géneros
Porthidium (patocos) y
Lachesis (verrugosos) muestran una esperanza de vida en cautiverio similar a la observada en las especies de
Micrurus, lo que indica que estas víboras también requieren cuidados y condiciones ambientales especializados. Dentro de los vipéridos alojados en el INS, estas especies son las más propensas a presentar signos extremos de mal adaptación o estrés fisiológico (Tabla 2). Curiosamente, ambos géneros representan los extremos de tamaño corporal entre las especies de vipéridos que habitan en Suramérica. Las especies del género
Porthidium son las víboras más pequeñas y las dos especies del género
Lachesis son las más grandes y pesadas, sugiriendo que el tamaño corporal juega un papel clave en la capacidad de las serpientes para sobrevivir en cautiverio.
Hay pocos datos previamente documentados que evalúen la supervivencia de especies venenosas de serpientes mantenidas en cautiverio para la producción de antiofídicos en Centro y Suramérica. Sin embargo, la expectativa de vida y el tiempo medio de supervivencia de las especies alojadas en el serpentario del INS tienen estrechas similitudes con estudios previos realizados en Costa Rica, aunque existen claras diferencias. Por ejemplo, Sasa et al.
[23] en el serpentario del Instituto Clodomiro Picado (ICP) de Costa Rica, establecieron cuatro perfiles de supervivencia estadísticamente distintos, que se asemejan mucho a las curvas de supervivencia encontrados para la población de serpientes cautivas del serpentario del INS. Por lo tanto, siguiendo la propuesta de Sasa et al.
[23], los perfiles de supervivencia estadísticamente distintos observados en el serpentario del INS coinciden con las siguientes categorías (Figura 7B):
Alta supervivencia —. Especies de serpientes en cautiverio que exhiben más del 70% de supervivencia durante los primeros 24 meses (720 días) y menos del 40% de las muertes ocurren después del mes 60 (1.800 días). Este perfil fue exhibido solo por
Crotalus durissus.
Decrecimiento constante —. Especies de serpientes en cautiverio en las que menos del 50% de los fallecimientos ocurren durante los primeros 24 meses, y seguidamente se observa una reducción gradual de la supervivencia. Este perfil fue mostrado solo por Bothrops asper y B. atrox.
Decrecimiento rápido —. Especies de serpientes en cautiverio en las que aproximadamente el 40% de los individuos sobreviven durante los primeros 24 meses (720 días), y se observa que la tasa supervivencia disminuye después de 48 meses (1.440 días). Ninguna especie siguió este perfil.
Decrecimiento severo —. Especies de serpientes en cautiverio en la que aproximadamente el 30% de los individuos sobreviven en los primeros 24 meses (720 días), y se observa una disminución constante de la supervivencia posteriormente. Este perfil fue exhibido por Micrurusdumerilii, M. mipartitus, Lachesis acrochorda y Porthidium lansbergii.
De forma similar, especies como
Porthidium nasutum y
Lachesis stenophrys (los parientes cercanos de
Porthidium lansbergii,Lachesis acrochorda,y L. muta, respectivamente) alojadas en el ICP
[23], mostraron una rápida disminución en las curvas de supervivencia, así como en supervivencia media más corta, similar al observado en poblaciones cautivas de sus congéneres colombianos. Además, ambas especies costarricenses también representan los extremos de tamaño corporal
[23,26].
En el caso de
Bothrops asper, la única especie compartida por ambos serpentarios, se observaron diferencias marcadas en el tiempo medio de supervivencia, siendo 2,3 veces más largo en la población de serpientes en cautiverio colombianas que las costarricenses. Además, ambas poblaciones en cautiverio de
Bothrops asper mostraron patrones distintos de supervivencia, donde la población colombiana exhibió un decrecimiento constante en su perfil de supervivencia, mientras que la población costarricense mostró un decrecimiento rápido.
Las diferencias observadas entre las poblaciones de
B. asper alojadas en ICP e INS pueden ser causadas por factores intrínsecos y extrínsecos relacionados con las condiciones de cautiverio o las características de la historia natural de cada especie, así como por la variabilidad intrínseca poblacional. Por ejemplo, estudios previos sobre la supervivencia de serpientes coral en cautiverio han encontrado asociaciones significativas con la condición corporal inicial durante la admisión en el serpentario, así como con los tipos de sustratos y los esquemas de alimentación durante el cautiverio
[21,22]. En Colombia, poblaciones en cautiverio de la serpiente coral
Micrurus mipartitus (rabo de ají) han demostrado que el peso y la condición corporal al ingreso juegan un papel importante en la expectativa de vida observada
[27].
Tabla 3. Modelos de riesgos proporcionales de Cox. La tabla muestra los valores de p de cada modelo, indicando la significancia estadística de cada covariable. La longitud rostro-cloaca (LRC), el peso, las patologías sinérgicas, los ectoparásitos, la disecdisis y la deshidratación se incluyeron como covariables intrínsecas de las serpientes durante la admisión en el serpentario del INS. Las patologías sinérgicas ilustran los casos en los que una serpiente presentó dos o más patologías al mismo tiempo (p. ej., ectoparásitos + disecdisis).
| Categorías de análisis |
Grupos |
N |
LRC |
Peso |
Patologías sinérgicas |
Ectoparásitos |
Disecdisis |
Deshidratación |
| Ecorregiones |
Amazonia |
|
28 |
0.387 |
0.0351 |
0.192 |
0.224 |
0.044 |
0.022 |
| Andina |
|
143 |
<0.001 |
0.0926 |
0.0049 |
0.445 |
0.425 |
0.135 |
| Caribe |
|
64 |
0.52 |
0.99 |
0.273 |
0.531 |
0.187 |
<0.0001 |
| Orinoquia |
|
67 |
0.033 |
0.0111 |
0.968 |
0.796 |
NA |
NA |
| Pacífico |
|
4 |
0.047 |
0.025 |
0.277 |
0.107 |
NA |
0.909 |
| Valles interandinos |
|
31 |
0.13 |
0.097 |
NA |
NA |
NA |
NA |
| Familias |
Elapidae |
|
101 |
0.0068 |
0.736 |
<0.0001 |
0.423 |
0.0167 |
0.916 |
| Viperidae |
|
209 |
0.245 |
0.265 |
0.429 |
0.203 |
0.06 |
0.0028 |
| Especies de Vipéridos |
Bothrops asper |
|
70 |
0.701 |
0.867 |
0.703 |
<0.0001 |
0.131 |
0.0085 |
|
Bothrops atrox |
|
36 |
0.0147 |
0.0054 |
<0.0001 |
<0.0001 |
0.0001 |
1 |
|
Crotalus durissus |
|
20 |
0.884 |
0.976 |
0.15 |
NA |
0.99 |
1 |
| Especies de Micrurus |
M. dumerilii |
|
66 |
0.0092 |
0.931 |
0.0011 |
0.381 |
0.019 |
0.861 |
|
M. mipartitus |
|
31 |
0.265 |
0.69 |
0.171 |
NA |
0.63 |
NA |
|
Escala de color del P-valor |
 |
NA: Datos no disponibles. Escala de colores del valor de probabilidad que ilustra la significancia estadística de las diferencias locales entre los modelos de riesgos proporcionales de Cox y las covariables intrínsecas evaluadas.
Para este estudio, nos enfocamos en evaluar los factores intrínsecos de las serpientes al momento de su ingreso al serpentario del INS, como el tamaño corporal, el peso y la presencia/ausencia de patologías, ectoparásitos, disecdisis y deshidratación. Los modelos de riesgos proporcionales de Cox (CPH acrónimo en inglés) indican que las principales patologías observadas durante la última década en el serpentario del INS pueden actuar de manera independiente o sinérgica. En general, la supervivencia de las serpientes en cautiverio mostró una correlación significativa con las covariables intrínsecas evaluadas (Tabla 3). El tamaño corporal (LRC) fue la variable explicativa más frecuente, siendo significativa en el 46% de las categorías de análisis evaluadas, seguido por disecdisis (38%), peso, patologías sinérgicas y deshidratación (31% cada una), y ectoparásitos (15%). Estos resultados eran esperados, ya que el tamaño corporal y la pérdida de peso son factores de riesgo comunes en animales en cautiverio
[28].
La deshidratación mostró una marcada correlación con el origen ecorregional de la serpiente o su familia taxonómica. Cuando se presenta este signo por sí solo, se correlaciona significativamente con la probabilidad de supervivencia de los vipéridos que provienen de localidades de la Amazonía y el Caribe. En cambio, cuando la deshidratación se presenta sinérgicamente con otras patologías, se correlaciona significativamente con la probabilidad de supervivencia de las serpientes que provienen de localidades Andinas, sobresaliendo
Micrurus dumerillii al presentar una alta significancia.
Este hallazgo es interesante, ya que como se indicó anteriormente, esta especie de coral es propensa a mostrar síndrome de mal adaptación, exhibiendo tiempos medios de supervivencia muy cortos. En general, estos hallazgos sugieren que las interacciones sinérgicas podrían modular o reducir la esperanza de vida de las serpientes en cautiverio. Las interacciones sinérgicas de dos o más patologías son un tema importante para el mantenimiento de serpientes en cautiverio porque pueden generar una respuesta deletérea mayor que cuando las patologías actúan solas. Desafortunadamente, la escasez de información e investigaciones sobre las interacciones patológicas sinérgicas en serpientes tropicales sudamericanas hace que nuestra comprensión y conocimiento sea extremadamente insuficiente.
La probabilidad de supervivencia de las serpientes en cautiverio mostró una correlación significativa con la disecdisis, particularmente en especies de vipéridos y elápidos provenientes de localidades de la Amazonía. A diferencia de las interacciones patológicas sinérgicas, esta patología es bien conocida y se considerada como un factor de riesgo importante en reptiles en cautiverio, debido a que deriva de causas multifactoriales, tales como: (1) manejo inadecuado de la de humedad o temperatura del encierro; (2) cicatrices de viejas heridas, cirugías o quemaduras; (3) infecciones parasitarias y enfermedades sistémicas; y (4) enfermedades subyacentes que causan deshidratación o alteración del movimiento (p. ej., vértebras fusionadas)
[29].
Sin embargo, cada grupo de serpientes evaluado exhibió una combinación única de variables explicativas, pero con algunos puntos en común entre los modelos CPH. Esto sugiere que se deben realizar estudios futuros centrándose en las variables aquí exploradas como origen, localidad/ecorregión, y no exploradas como nivel de cortisol, estado de desarrollo, endoparásitos, etc. Por ejemplo, las serpientes de importancia médica de las ecorregiones de la Orinoquía y la Amazonía comparten el tamaño y peso corporal como variables explicativas. Esto era de esperarse porque ambas regiones abarcaron la distribución histórica de
Lachesis muta, especie que representa el tamaño corporal más extremo entre las víboras sudamericanas.
3. Comprendiendo la muerte de las serpientes en cautiverio
Desde 2010, todas las serpientes fallecidas en cautiverio en el serpentario del INS han sido examinadas empleando un protocolo estandarizado que busca comprender las causas de la muerte. Los resultados de las necropsias se documentaron y registraron en la historia clínica de cada espécimen. La recopilación de estos registros año a año proporcionó la base de información que permitió realizar el análisis aquí expuesto, así como identificar las patologías y sus impactos en la población general del serpentario. Comprender las causas de la muerte de las serpientes en cautiverio proporciona un aporte importante para mejorar las técnicas de manejo y tenencia en un programa de cautiverio de serpientes para la producción de antiofídico a gran escala
[23,30].
Las siguientes descripciones y análisis se basaron en 264 necropsias realizadas por veterinarios desde 2010 hasta enero de 2021, en serpientes que fallecieron en condiciones de cautiverio abarcando: 99 elápidos. (M. camilae,
M. dissoleucus,
M. dumerilii,
M. filiformis,
M. helleri,
M. hemprichii,
M. medemi,
M. mipartitus,
M. nattereri,
M. obscurus, y
M. surinamensis) y 165 vipéridos (Bothriechis schlegelii,
Bothrocophiastulitoi,
Bothropsasper,
B. atrox,
B. bilineatus,B. venezuelensis,
Crotalus durissus,
Lachesis acrochorda,L. muta, y
Porthidium lansbergii; Tabla 4). En su mayoría, los registros de las necropsias provinieron del serpentario del INS de la Hacienda Galindo en el municipio de Bojacá, Cundinamarcadesde el año 2012 (ver Capítulo 7).
Las anormalidades en el sistema digestivo y respiratorio fueron los principales hallazgos. Representaron el 43,3% del total de hallazgos
post mortem, seguidos por la ausencia de anormalidades (Figura 8). Las anormalidades digestivas en las serpientes son la principal causa de infecciones. Sin embargo, debido a la falta de pruebas de diagnóstico establecidas o referencias clínicas publicadas, resulta desafiante realizar una interpretación correcta de los signos clínicos para la mayoría de las especies de serpientes
[31,32]. Los esfuerzos de investigación en técnicas diagnósticas, especialmente de imágenes clínicas (p. ej., radiografía de contraste y ultrasonografía) del tracto gastrointestinal, han dado lugar a avances clínicos para los veterinarios en ejercicio
[32].
Sin embargo, debido a las limitadas condiciones técnicas en los serpentarios dedicados a la producción de antiofídicos, así como a la escasez de veterinarios especializados en reptiles disponibles en Colombia que podrían proporcionar un diagnóstico preciso, el tratamiento de los trastornos del sistema digestivo en serpientes en cautiverio es difícil
[31]. Por lo tanto, en las clínicas veterinarias de mascotas como en las unidades de producción de animales de laboratorio, o en serpentarios como el del INS, las enfermedades digestivas son una causa común de muerte, pero esta causa en su mayoría no puede detectarse hasta el examen
post mortem. Actualmente, no existen factores o condiciones del encierro plausibles que vinculen la muerte de una serpiente con las anormalidades observadas en el sistema digestivo. Este hallazgo requiere una investigación más detallada.
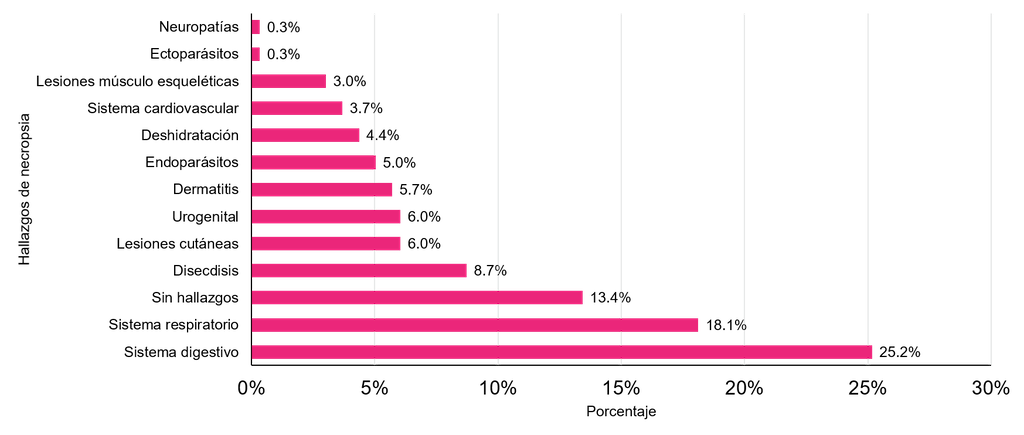
Figura 8. Principales hallazgos post mortem en especies de serpientes de importancia médica alojadas en el serpentario del INS durante 2010-2021.
Las enfermedades respiratorias en las serpientes tienen orígenes multifactoriales, incluyendo bacterias, virus, parásitos, hongos, estrés, espacio del encierro, genética, ecdisis, fisiológica, entre otras.[33]. Estas enfermedades son comunes en serpientes en cautiverio, ya que el diseño y el espacio del recinto o encierro impactan directamente en la salud de las serpientes. Estos factores afectan el comportamiento normal y la movilidad de las serpientes, así como las condiciones adicionales de cautiverio como el saneamiento y la humedad, o condiciones fisiológicas como la termorregulación.
[28]. Un recinto ideal debe proporcionar un área seca y caliente; una zona cálida y húmeda; un área fresca y seca; y un área fresca y húmeda
[28]. Sin embargo, como se describió anteriormente, debido al limitado espacio disponible en el serpentario del INS, todos los encierros tienen las mismas condiciones ambientales y son homogéneos. Carecen de una oferta termal diversa. Por lo tanto, la exposición prolongada a condiciones de temperatura y humedad invariantes en el ambiente en cautiverio podría explicar las anormalidades observadas. Sin embargo, se deben realizar esfuerzos de investigación futuros para evaluar esta hipótesis.
Tabla 4. Principales causas de muerte en especies de serpientes de importancia médica alojadas en el serpentario del INS durante el periodo 2010-2021.
| Taxon |
N |
MCAI |
Iatrogenia |
Muerte accidental |
Síndrome de mal adaptación |
Causa desconocida |
| Elapidae |
99 |
14 (14,14%) |
5 (5,05%) |
6 (6,06%) |
36 (36,36%) |
38 (38,38%) |
|
M. camilae |
1 |
|
|
|
|
1 (1,01%) |
|
M. dissoleucus |
2 |
|
1 (1,01%) |
|
1 (1,01%) |
|
| M. dumerilii |
46 |
9 (9,09%) |
2 (2,02%) |
|
15 (15,15%) |
20 (20,2%) |
|
M. filiformis |
1 |
|
1 (1,01%) |
|
|
|
|
M. helleri |
7 |
1 (1,01%) |
|
|
3 (3,03%) |
3 (3,03%) |
|
M. hemprichii |
2 |
|
|
1 (1,01%) |
|
1 (1,01%) |
|
M. medemi |
8 |
|
|
1 (1,01%) |
|
7 (7,07%) |
|
M. mipartitus |
24 |
3 (3,03%) |
|
4 (4,04%) |
13 (13,13%) |
4 (4,04%) |
|
M. nattereri |
1 |
|
1 (1,01%) |
|
|
|
|
M. obscurus |
1 |
|
|
|
1 (1,01%) |
|
|
M. surinamensis |
6 |
1 (1,01%) |
|
|
3 (3,03%) |
2 (2,02%) |
| Viperidae |
165 |
14 (8,48%) |
|
|
49 (29,69%) |
102 (61,82%) |
| Bothriechis |
|
|
|
|
|
|
|
B. schlegelii |
4 |
|
|
|
1 (0,61%) |
3 (1,82%) |
| Bothrocophias |
|
|
|
|
|
|
|
B. tulitoi |
2 |
1 (0,61%) |
|
|
1 (0,61%) |
|
| Bothrops |
110 |
6 (3,64%) |
|
|
30 (18,18%) |
74 (44,85%) |
|
B. asper |
66 |
4 (2,42%) |
|
|
20 (12,12%) |
42 (25,45%) |
|
B. atrox |
42 |
2 (1,21%) |
|
|
10 (6,06%) |
30 (18,18%) |
|
B. bilineatus |
1 |
|
|
|
|
1 (0,61%) |
|
B. venezuelensis |
1 |
|
|
|
|
1 (0,61%) |
| Crotalus |
|
|
|
|
|
|
|
C. durissus |
15 |
2 (1,21%) |
|
|
|
13 (7,88%) |
| Lachesis |
4 |
2 (1,21%) |
|
|
|
2 (1,21%) |
|
L. acrochorda |
1 |
1 (0,61%) |
|
|
|
|
|
L. muta |
3 |
1 (0,61%) |
|
|
|
2 (1,21%) |
| Porthidium |
|
|
|
|
|
|
|
P. lansbergii |
30 |
3 (1,82%) |
|
|
17 (10,3%) |
10 (6,06%) |
| Total |
264 |
28 (10,61%) |
5 (1,89%) |
6 (2,27%) |
85 (32,2%) |
140 (53,03%) |
N= Tamaño de muestra. MCAI= Mala condición corporal antes del ingreso.
El conocimiento de las enfermedades que contraen las serpientes y los agentes microbianos que portan es esencial para su manejo en cautiverio
[34,35]. No obstante, hay pocos estudios científicos que se centren en las enfermedades de las serpientes tropicales de Suramérica utilizadas para la producción de antiofídicos. Sin embargo, los informes de necropsias de la última década del serpentario del INS mostraron similitudes con lo observado en serpientes en cautiverio alojadas en zoológicos
[13,18,29,30].
Por ejemplo, las cinco causas más comunes de muerte en serpientes en cautiverio, en orden de importancia, son (Tabla 4):
-
Causas desconocidas.— Se define como la imposibilidad de establecer una causa médica de muerte a partir de los hallazgos observados en la necropsia. Esta causa agrupa la mayor proporción de fallecimientos de serpientes en todos los estudios previos
[13,18,29], y representó el 53% de las muertes en el serpentario del INS con una notable prevalencia en especies de vipéridos.
-
Síndrome de mal adaptación.— Se observó una prevalencia del 32,2% de en las serpientes en cautiverio del serpentario del INS, exhibiendo una aparente asociación con el tamaño corporal y origen ecorregional, siendo significativamente alta en las especies del género
Micrurus.
-
Mala condición corporal.— Son las muertes derivadas de una condición corporal deficiente antes de su ingreso. La frecuencia observada de estos casos en el serpentario de INS fue del 10,61%. Durante los primeros 150 días de cautiverio es una de las principales causas de muerte para todas las especies, pero presenta una alta prevalencia en las especies del género
Micrurus.
-
Muerte accidental.—. Son las muertes resultantes de un evento accidental en condiciones de cautiverio. Esta causa tuvo una baja prevalencia (2,27%), siendo el principal accidente la asfixia mecánica producida por el intento de escape del encierro.
-
Iatrogenia.— Son las muertes relacionadas con una enfermedad o lesión causada durante el examen o tratamiento médico. Esta causa tuvo la más baja frecuencia (1,89%) entre las causas de muerte observadas en el serpentario de INS. No obstante, cuando ocurría, las corales eran las más propensas a morir por procedimientos médicos.
4. Lecciones aprendidas
4.1 Lección uno: Alimentación y nutrición
Una de las principales preocupaciones de mantener serpientes en cautiverio para la producción de antiofídico, es proporcionar una alimentación y nutrición adecuada; el objetivo es prolongar la vida saludable del animal en la medida de lo posible. La alimentación constituye una de las actividades más importantes y decisivas para el mantenimiento y la supervivencia de las serpientes en cautiverio. La mayoría de las serpientes en cautiverio prefieren presas vivas o presas que han sido recién eutanasiadas, aunque también las serpientes en cautiverio aceptan presas muertas
[36]. La última opción ha sido comúnmente adoptada por cuidadores de serpientes en zoológicos o exposiciones biológicas educativas, pero las presas muertas no son compatibles con las buenas prácticas para la producción de antiofídicos.
Para alcanzar los estándares internacionales de producción, deben diseñarse procedimientos especiales, considerando los siguientes aspectos: (1) elegir una técnica de alimentación adecuada según el tipo de dieta de cada especie de serpiente; (2) establecer un esquema de alimentación de acuerdo con las necesidades de la serpiente, incluyendo los siguientes criterios: estado de salud, tamaño corporal, índice de masa corporal y etapa de desarrollo (neonato, juvenil, adulto); y (3) los procedimientos de alimentación deben ser realizados por personal con experiencia y capacitados para esta tarea.
La mayoría de los problemas de alimentación y nutrición surgen de un cuidado o manejo inadecuado, combinado con una gestión deficiente de la alimentación
[37]. Esta lección resume las principales conclusiones obtenidas al resolver problemas de alimentación y nutrición de serpientes tropicales a lo largo de la historia del serpentario del INS, buscando minimizar las muertes y enfermedades causadas por la desnutrición
Alimentación voluntaria
Como directriz principal, los cuidadores de serpientes deben mantener y promover, tanto como sea posible, los estímulos voluntarios de alimentación de las serpientes cuando ingresan al serpentario provenientes de su entorno natural. Mantener constantes los estímulos de alimentación voluntaria evita la aparición del síndrome de mal adaptación. Para lograr esto exitosamente, los procedimientos de alimentación deben realizarse durante el día en un recinto cálido con temperaturas que oscilan entre 26° y 30°C, proporcionando presas vivas. Tanto para elápidos como vipéridos tienden a alimentarse utilizando este enfoque; sin embargo, los pasos técnicos difieren. El enfoque técnico utilizado para alimentar a las víboras es el siguiente (Figura 9):
- El cuidador de serpientes debe sacar la serpiente de su encierro y colocarla en una caja para pesarla; esto permite determinar la presa que se le dará. Este procedimiento debe realizarse previamente a los siguientes pasos.
- El cuidador de serpientes selecciona un roedor acorde al peso de la serpiente (~ 10% del peso de la serpiente).
- Se abre el encierro de la serpiente, y se utiliza la tapa del encierro como barrera de seguridad adicional. El roedor se sostiene con unas pinzas largas y se le ofrece realizando movimientos suaves a 10 o 20 cm de la cabeza de la serpiente buscando estimular a la serpiente para que muerda o ataque la presa. La distancia a la que se ofrece la presa a las serpientes varía según su tamaño corporal; recomendamos realizar movimientos suaves al ofrecer la presa a una distancia no mayor al 30% de la longitud del cuerpo de la serpiente.
- Una vez que la serpiente muerde o ataca la presa, la presa se libera de las pinzas depositándola en el encierro, y se tapa el encierro. Si la serpiente se niega a morder la presa, esta se retira y se pospone la oferta de presas hasta la segunda ronda de alimentación. La presa debe retirarse para evitar el estrés psicológico. La presa no debe introducirse en el encierro sin verificar que la serpiente haya realizado una mordedura efectiva en la que inocule el veneno y produzca su muerte, ya que esta puede atacar la serpiente e inducir una infección y/o lesión grave o potencialmente mortal.
- En el caso de que se necesite más de una presa para alcanzar el 10% del peso de alimentación requerido, el cuidador de serpientes debe esperar a una segunda ronda de alimentación, verificando que la serpiente haya ingerido completamente el primer roedor; luego se ofrece la presa adicional. En caso de un retraso en el consumo del primer roedor, el cuidador realiza la eutanasia a un segundo roedor y lo deja dentro del encierro. La ingestión de la presa por parte de la serpiente debe ser confirmada; de lo contrario, debe retirarse.

Figura 9. Pesaje y alimentación de víboras. (A) Abrir el recinto de la serpiente usando la tapa como barrera protectora. (B) Con un gancho para serpientes, trasladar la serpiente a una caja vacía para pesarla. (C) Cerrar la caja en la que se pesará la serpiente usando la misma tapa de la caja. (D) Pesar la serpiente en una balanza. (E) Devolver la serpiente a su caja y cerrarla. (F) Pesar el roedor en una balanza. (G) Ofrecer el ratón a la serpiente sosteniéndolo con unas pinzas largas y realizando movimientos suaves. (H) La serpiente muerde o ataca la presa; la presa se libera de las pinzas. (I) Se cierra la caja.
El INS cuenta con bioterio independiente del serpentario, en cual se realiza la producción de roedores certificados criados en condiciones controladas, proporcionando una dieta adecuada y libre de patógenos para las serpientes (Tabla 5). Por lo tanto, el serpentario del INS siempre tiene una amplia oferta dietaría que varía en tamaño y peso de acuerdo con las necesidades de las serpientes.
Tabla 5. Roedores criados en condiciones controladas utilizados para alimentar a los vipéridos alojados en el serpentario del INS.
| Tipo |
Cepa |
Código de la cepa |
Color del pelaje |
| Ratón |
BALB/c |
028 |
Albino |
| Ratón |
CD1(ICR) |
022 |
Albino |
| Rata |
Wistar |
003 |
Albino |
| Cobayos, cuy |
Hartley |
051 |
Albino |
| Gerbil |
Mongolian |
243 |
Agouti |
| Hamster |
Syrian |
249 |
Dorado |
A diferencia de las víboras, alimentar a las serpientes coral con animales vivos presenta enormes restricciones y problemas técnicos que reducen la posibilidad de mantener los estímulos que propendan por la alimentación voluntaria. En primer lugar, debido a que las serpientes coral habitan entre el suelo y la hojarasca (semifosoriales), su dieta consiste principalmente en otras serpientes, lagartos sin extremidades, cecilias, anguilas de pantano y peces cuchillo
[38]. En la práctica, la recolección, mantenimiento o cría en cautiverio de este tipo de presas es muy difícil y no es sostenible. Por lo tanto, alimentar a las corales con animales vivos en el contexto de los estándares internacionales de producción de antiofídicos no es factible, o resulta muy costoso. En segundo lugar, dado que estas presas se obtienen de ambientes silvestres, no es posible garantizar que estén libres de patógenos, y sería muy difícil higienizarlas. En tercer lugar, proporcionar una alimentación programada y continua según las necesidades de las serpientes basado en presas obtenidas de ambientes silvestres, es difícil de lograr.
De manera que, en la práctica, alimentar serpientes coral con animales vivos es una actividad ocasional y oportunista. El objetivo de ofrecer presas vivas es estimular la alimentación voluntaria, evitando el manejo directo, con posibles efectos perjudiciales como la alimentación forzada con presa viva. En el serpentario del INS, la alimentación con animales vivos para serpientes coral es ocasional. La alimentación voluntaria se ha realizado con éxito en algunos individuos de
Micrurus dumerilii, M. mipartitus, M. helleri, M. sangilensis y
M. hemprichi, ofreciéndole serpientes vivas de los géneros
Ninia, Atractus, Oxyrhopus y
Stenorrhina; y lagartos con extremidades reducidas del género
Bachia. El enfoque técnico utilizado para alimentar con presas vivas a serpientes coral es el siguiente:
- El cuidador de serpientes debe sacar la serpiente de su encierro y colocarla en una caja para pesarla para determinar la presa que se le administrará. Este procedimiento debe realizarse antes de los siguientes pasos.
- El cuidador selecciona una presa según la longitud y el peso de la serpiente (menos del 50% de la longitud de la serpiente y aproximadamente el 10% de su peso).
- La presa se libera viva en el recinto y luego se cierra. El cuidador debe hacer rondas verificando que la serpiente haya atacado e ingerido la presa. Si no ingiere la presa, esta debe retirarse. De esta manera, se estimula a la serpiente coral a buscar y usar la vista y el olfato para alimentarse.
- El consumo de la presa debe confirmarse en un período de dos días, de lo contrario, la presa debe retirarse.
Alimentación forzada
La alimentación forzada se refiere a la provisión mecánica forzada de presas o fórmula nutritiva. Este procedimiento es practicado por los cuidadores de serpientes cuando las serpientes rechazan repetidamente la presa durante más de cuatro meses, debido a la prevalencia de alguna condición médica o cuando las limitaciones operativas hacen que la alimentación con animales vivos no sea factible. Este procedimiento se puede realizar de dos maneras. Primero, utilizando una pinza con la cual la presa completa se introduce manualmente en el tracto digestivo de la serpiente, evitando el uso de cualquier tipo de herramienta restrictiva para sujetar a la serpiente (p. ej., tubo de restricción). La presa debe ser seleccionada según la longitud y el peso de la serpiente, como se describió anteriormente. En segundo lugar, mediante la introducción de una sonda orogástrica en el tracto digestivo de la serpiente, se inyecta suavemente una fórmula nutritiva. A continuación, se describen ambas técnicas.
Alimentación forzada utilizando una presa entera.— De acuerdo con la experiencia acumulada en el serpentario del INS, esta técnica se utiliza principalmente en víboras en lugar de corales, ya que estas últimas tienden a estar altamente estresadas por el manejo durante el procedimiento de alimentación. La mayoría de las víboras toleran la manipulación sin mayores dificultades durante la alimentación forzada. El enfoque técnico utilizado para alimentar a las serpientes con una presa enteras es el siguiente:
- El cuidador debe sacar a la serpiente de su encierro y colocarla en una bolsa de tela/caja para pesarla. Esto permite determinar la presa que se administrará. El procedimiento debe realizarse entre cinco y diez días antes de la alimentación.
- El cuidador de serpientes selecciona una presa de acuerdo con el peso de la serpiente (~ 10% del peso de la serpiente).
- La presa sacrificada se humedece con agua para su lubricación.
- Capturar y manipular suavemente a la serpiente que se va a alimentar, se recomienda que los siguientes pasos sean realizados por dos cuidadores. El primer cuidador se encarga de capturar y sostener la serpiente, mientras que el segundo cuidador se encarga de realizar la alimentación. Evite el uso de cualquier tipo de herramienta restrictiva para sostener la serpiente durante el procedimiento de alimentación (p. ej., tubo de contención).
- Se utiliza una pinza larga (al menos 20 cm) para sostener con las puntas de la pinza la presa previamente lubricada.
- Inserte la presa previamente lubricada (introduciendo primero la cabeza) en la boca de la serpiente.
- Empuje suave y lentamente la presa previamente lubricada en el tracto digestivo de la serpiente, pasando la cabeza hasta alcanzar una distancia equivalente a la longitud de la cabeza de la serpiente. Después, libere la presa de la pinza.
- Con la mano libre, el cuidador que ejecuta la técnica de alimentación debe masajear suavemente la superficie ventral de la serpiente, desplazando lentamente la presa hasta llegar aproximadamente al final del primer tercio del cuerpo de la serpiente.
- Liberar a la serpiente en su encierro y cerrarlo. Verificar la aceptación de la presa durante 24 horas. En caso de regurgitación de la presa, esta debe ser descartada.
Alimentación forzada utilizando una fórmula nutritiva.— Esta técnica representa uno de los mayores éxitos del serpentario del INS en la última década. El uso de una fórmula nutritiva como alimentación alternativa permitió consolidar una población estable de serpientes
Micrurus que supera la esperanza de vida promedio de 1,4 años y un tiempo mediano de supervivencia de 91 días, incluyendo ejemplares en cautiverio con una esperanza de vida de 8 años.
La experiencia acumulada nos enseña que los dos principales factores de éxito fueron: (1) La composición de la fórmula nutritiva; y (2) la mejora progresiva de la técnica y la experiencia adquirida por los cuidadores para realizar este procedimiento, que incluyen la adecuada manipulación, introducción de un catéter Nelaton en el tracto digestivo de las serpientes, y la ejecución precisa del protocolo de alimentación utilizando la fórmula nutritiva.
El desarrollo de la fórmula nutritiva fue la respuesta a las fuertes restricciones para obtener presas del medio natural que permitieran la alimentación continua y acordes a las necesidades de las serpientes coral, así como el rechazo frecuente de presas vivas en los primeros meses de cautiverio por las especies de
Micrurus. La fórmula nutritiva es una solución hiperproteica basada en huevos de gallina criolla (criolla = una gallina criada de manera natural en el campo) mezclada con Casilan® (Composición: proteínas = 95 %, carbohidratos = 1 %; grasas = 4 %) más suplementos de vitaminas y aminoácidos. Según la experiencia de los veterinarios del serpentario del INS, el uso de huevos de gallina criolla es obligatorio. El uso de otros tipos de huevos provocó el rechazo de la fórmula nutritiva por parte de las serpientes. Debido a que Casilan® desapareció del mercado colombiano en 2021, este se sustituyó por Reptomin® (Composición: proteínas = 44 %, carbohidratos = 3 %; grasas = 5 %, humedad = 9 %, calcio = 0.3 %, fósforo = 0.4 %), obteniendo los mismos buenos resultados a los observados con el Casilan®.
La fórmula nutritiva ha mostrado excelentes resultados para la mayoría de las serpientes coral, aunque no es una solución infalible. Después de alimentar diez
Micrurus surinamensis (serpiente coral acuática) con una fórmula nutritiva que reemplazó los huevos de gallina criolla por pescado como fuente proteica, todas las serpientes presentaron signos de enfermedad graves que amenazaban su vida, como piel opaca, ecdisis incompleta e inmovilidad. Por lo tanto, el uso de una fórmula nutritiva basada en una dieta de pescado fue contraindicado. Para el caso de
M. surinamensis, se recomienda alimentar con una fórmula nutritiva basada en agua más Reptomin® o Casilan®. Esta ha mostrado resultados aceptables, aunque aún es un desafío alimentar corales acuáticas.
La preparación y administración de la fórmula nutritiva debe realizarse con cuidado, procurando que la consistencia de la fórmula sea muy líquida. Las consistencias densas dificultan la digestión. Los grumos o burbujas pueden causar la ruptura del tracto digestivo durante la administración. El tiempo de manipulación debe minimizarse mediante la administración rápida de la fórmula nutritiva. Por lo tanto, la introducción del catéter Nelaton debe ser rápida, empujando suavemente el catéter hacia el tracto digestivo de la serpiente. El calibre del catéter Nelaton debe seleccionarse según la longitud del cuerpo de la serpiente. La manipulación debe realizarse con las manos evitando el uso de pinzas u cualquier tipo de herramienta restrictiva, ya que estos elementos provocan estrés en la serpiente y el rechazo de la fórmula nutritiva.
El consumo de la fórmula nutritiva debe registrarse en la historia clínica de cada serpiente. Según la experiencia acumulada alimentando corales, la proporción adecuada de fórmula nutritiva oscila entre el 10% y el 30% del peso de la serpiente, considerando una proporción de 1:1 (peso corporal g/fórmula mL). Sin embargo, la proporción de la fórmula nutritiva suministrada puede variar entre los individuos debido al desarrollo, la condición médica o la condición corporal de la serpiente. Se debe consultar la historia clínica de cada serpiente para ajustar el porcentaje según los registros históricos.
Tres cuidadores deben realizar la alimentación forzada con la fórmula nutritiva. La aproximación técnica empleada para realizar la alimentación es el siguiente (Figura 10):
- Los cuidadores deben sacar a la serpiente de su encierro utilizando un gancho herpetológico delgado y colocarla en una bolsa de tela para pesarla y así estimar el volumen de fórmula a administrar.
- Preparar un catéter Nelaton y una jeringa según el tamaño del cuerpo de la serpiente con fórmula nutritiva (una jeringa de 3 mL con catéter Nelaton de calibre 6 para serpientes con un tamaño corporal menor a 20 cm; una jeringa de 20 mL con catéter Nelaton de calibre 9 o 10 para serpientes con un tamaño corporal mayor a 20 cm).
- La alimentación forzada con la fórmula nutritiva debe realizarse, evitando el uso de pinzas o cualquier tipo de herramienta restrictiva (p. ej., tubos de restricción). El primer cuidador se encarga de capturar y sostener a la serpiente, el segundo cuidador se encarga de realizar el procedimiento de alimentación, y el tercero del masaje sobre la superficie ventral de la serpiente.
- El primer cuidador de serpientes introduce el catéter Nelaton hasta el primer tercio del cuerpo de la serpiente. Debe introducirse con un empuje suave pero rápido en el tracto digestivo.
- Inmediatamente después de la introducción del catéter Nelaton, el segundo cuidador debe administrar de forma controlada la fórmula, mientras que el tercer cuidador sostiene el cuerpo de la serpiente, realizando un masaje suave en la superficie ventral del animal. La administración de la fórmula nutritiva debe realizarse a una velocidad constante, controlando el émbolo de la jeringa, evitando la acumulación o generación de burbujas que pueden provocar indigestión u obstrucción del tracto digestivo.
- Una vez que se ha administrado todo el volumen de la fórmula nutritiva, el catéter Nelaton se retira lenta y suavemente del tracto digestivo. La boca de la serpiente debe lavarse con agua antes de soltarla y devolverla al encierro.
- Devolver la serpiente a su encierro. Verificar la aceptación de la fórmula nutritiva durante 24 horas. En caso de regurgitar la fórmula, limpiar el encierro y volver a programar un procedimiento de alimentación.
Nota: Este procedimiento de alimentación no puede llevarse a cabo en ejemplares que estén mudando de piel, a menos que el veterinario sugiera que es seguro hacerlo. Si es necesario realizar algún procedimiento médico adicional, este debe llevarse a cabo antes del procedimiento de alimentación.
La frecuencia de alimentación establecida en el serpentario del INS es mensual para vipéridos y quincenal para elápidos. Sin embargo, los neonatos de serpientes de ambos grupos se alimentan cada 10 o 15 días debido a sus altas demandas metabólicas. Otras razones para realizar un cambio en la frecuencia de alimentación obedecen a decisiones médicas veterinarias específicas. Los esquemas de alimentación, establecidos a lo largo de 10 años en el serpentario del INS, han presentado muy buenos resultados. Sin embargo, recomendamos que cada serpentario, según las especies de serpiente alberga, evalúe sus recursos disponibles para establecer los esquemas de alimentación más adecuados.
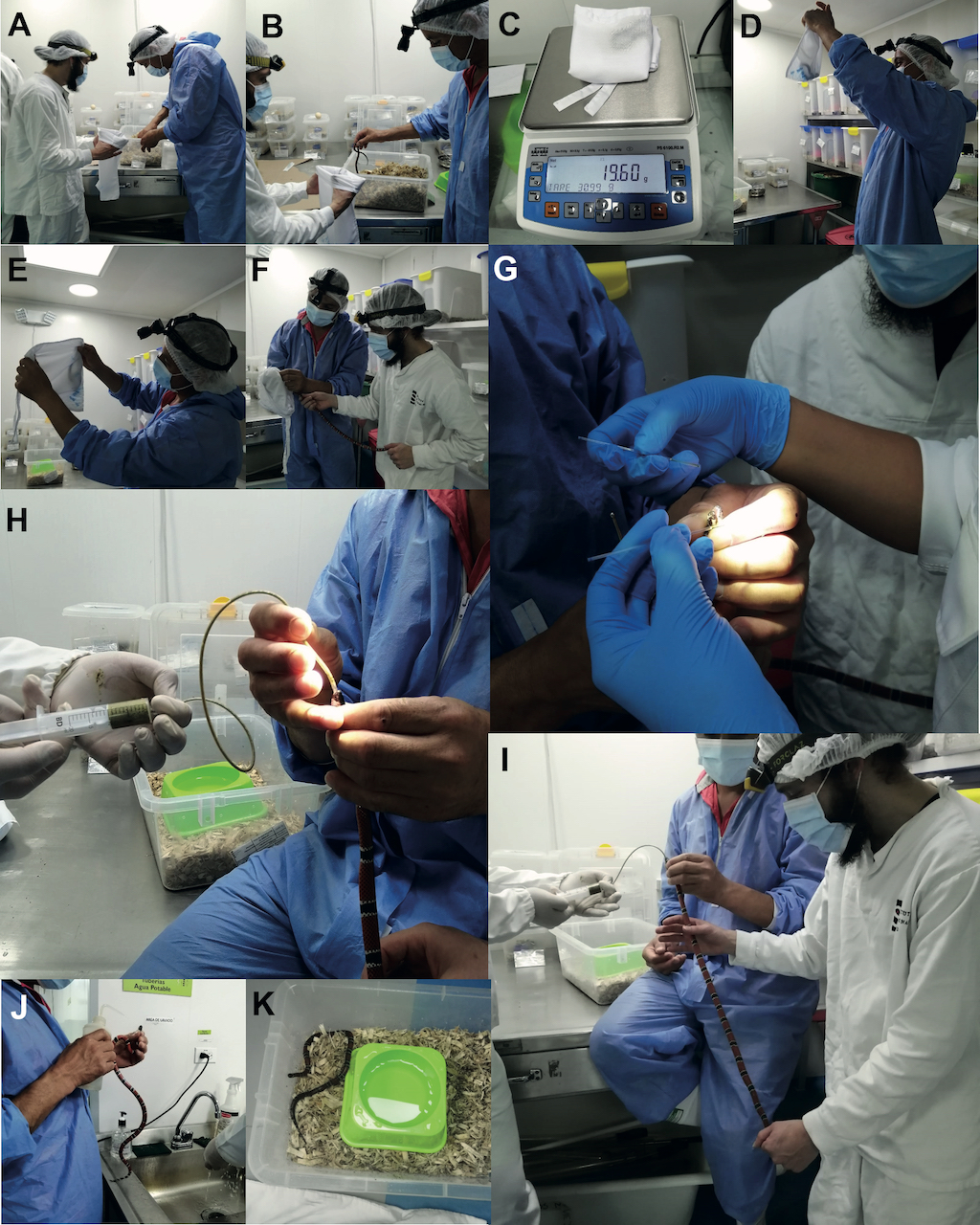
Figura 10. Proceso de pesaje y alimentación de las especies de Micrurus. (A) Abrir el encierro de la serpiente utilizando la tapa como barrera protectora. (B) Usar un gancho herpetológico delgado para trasladar la serpiente de su encierro a una bolsa de tela vacía (tela de dacrón blanco). (C) Doblar la bolsa blanca y pesar la serpiente. (D-E) El primer cuidador, coloca la bolsa de tela a contraluz y localiza la cabeza de la serpiente y la restringe. (F) El primer cuidador mantiene la cabeza de la serpiente mientras el segundo cuidador sostiene suavemente el cuerpo de la serpiente. (G) Un tercer cuidador extrae el veneno utilizando dos tubos capilares. (H) El primer cuidador de serpientes introduce el catéter Nelaton hasta el primer tercio del cuerpo de la serpiente. La inserción debe realizarse con un empuje suave pero rápido en el tracto digestivo. (I) El segundo cuidador administra de forma controlada la fórmula nutritiva, mientras un tercer cuidador sostiene el cuerpo de la serpiente y realiza un masaje suave en la superficie ventral del animal. (J) El catéter Nelaton se retira lentamente del tracto digestivo. La boca de la serpiente debe lavarse con agua antes de devolverla a su encierro. (K) La serpiente se devuelve a su encierro.
4.2 Lección dos: Iatrogenia
A pesar de que las muertes iatrogénicas representan menos del 2% de todos los fallecimientos de serpientes en la última década en el serpentario del INS, como lección aprendida, es importante describir los eventos más relevantes a ser considerados en futuras implementaciones en el marco de un programa para la producción de antiofídicos a gran escala.
Caso 1: rotura del tracto digestivo.— La alimentación forzada utilizando una fórmula nutritiva administrada a través de un catéter Nelaton es una técnica adaptada de procedimientos de alimentación utilizadas en modelos murinos con fines de investigación
[39]. En consecuencia, no existen referencias de su uso en serpientes en condiciones de cautiverio, por lo que nuestro aprendizaje se realizó a través de la experiencia. La alimentación forzada empleando un catéter Nelaton requiere un cuidador con experiencia, pero mientras se gana la experiencia, surgen errores y accidentes, de los cuales uno de los más comunes es la ruptura del tracto digestivo.
Los principales factores que contribuyen a la rotura del tracto digestivo son los siguientes: (1) selección inadecuada del tamaño del catéter Nelaton que no coincide con el tamaño del cuerpo de la serpiente; (2) una introducción inadecuada del catéter de Nelaton que sobrepasa el primer tercio del cuerpo de la serpiente; (3) un empujón demasiado rápido y fuerte durante la introducción del catéter de Nelaton; (4) un suministro descontrolado de la fórmula nutritiva que genera acumulación y burbujas; (5) no realizar el masaje sobre la superficie ventral de la serpiente; y (6) una extubación rápida e incontrolada. Según nuestra experiencia, la muerte por rotura del tracto digestivo se puede detectar dentro de las 72 horas después del procedimiento de alimentación forzada.
4.3 Lección tres: enriquecimiento ambiental
El enriquecimiento ambiental es el conjunto de técnicas y medidas de manejo utilizadas por los cuidadores que buscan fomentar la expresión de comportamientos naturales de los animales en condiciones de cautiverio.
[40]. Además, estas medidas de manejo buscan promover e incrementar la supervivencia, la salud y el bienestar de los animales en cautiverio
[41].
Históricamente, el enriquecimiento ambiental de serpientes en cautiverio se ha estudiado principalmente en zoológicos y biodioramas educativos, pero poco se ha avanzado en serpentarios que tienen por objetivo la producción de antiofídicos
[25]. Por ejemplo, para iniciativas públicas de educación ambiental, Cardoso et al.
[42] demostraron que los ambientes enriquecidos tienen efectos significativamente positivos sobre el bienestar y el comportamiento de las poblaciones en cautiverio de
Micrurus corallinus, reduciendo el estrés y previniendo síndromes de mala adaptación.
El enriquecimiento ambiental de serpentarios enfocados a la producción de antiofídicos es un desafío debido a la falta de investigaciones que exploren cuáles son las «mejores» prácticas. En particular, el enriquecimiento ambiental conlleva superar desafíos especiales debido a los protocolos estandarizados de sanidad animal en el contexto de un programa intensivo de cautiverio de serpientes que busca replicabilidad y reproducibilidad
[25]. Por ejemplo, para mantener altos estándares de saneamiento todos los elementos (ramas de árboles, rocas, trozos de troncos, plantas, etc.), tanto naturales como artificiales, deben ser higienizados para convertirlos en elementos asépticos y controlar los focos de patógenos. Muchos desinfectantes se inactivan en presencia de materia orgánica, por lo que lavar y desinfectar troncos y plantas es inútil para la sanidad de las serpientes.
Para un serpentario intensivo para la producción de antiofídicos, es una tarea desafiante cumplir con los requisitos de un buen enriquecimiento ambiental. Esto se debe a que diariamente se cuida y revisa el estado de salud de un gran número de serpientes, se realizan tareas de ordeño que consumen mucho tiempo, y se debe contar con personal capacitado e infraestructura especializada. Comúnmente en este tipo de serpentario existe un equilibrio entre el enriquecimiento ambiental y el manejo operativo de las serpientes. Los extremos de este compromiso entre lo natural y lo operativo son, por un lado, un biodiorama o terrario enriquecido ambientalmente que busca ser una réplica fiel del microhábitat conocido de la serpiente (como un serpentario de exhibición) y, por otro lado, un recinto básico sin elementos que simulen el microhábitat de la serpiente, sólo proveyendo agua
ad libitum.
La experiencia adquirida durante la historia del serpentario del INS, sugiere que el punto medio entre ambos extremos es la «mejor» opción a pesar de tener múltiples necesidades de enriquecimiento ambiental debido la diversidad la especie de serpientes que alberga. El serpentario del INS sigue el enfoque de Loughman
[43], pero lo ajusta de acuerdo con las pautas operativas estrictas y estandarizadas del INS en materia de salud, bienestar animal, seguridad de los trabajadores, calidad del producto y trazabilidad. Estas pautas son similares a las establecidas por el Centro de Estudio de Venenos y Animales Venenosos (CEVAP) de la Universidad Estadual Paulista (UNESP) Brasil
[25]; y las directrices de la Organización Mundial de la Salud (OMS) para la producción de antiofídicos
[44].
Serpentario intensivo
Condiciones generales en cautiverio.— El serpentario del INS alberga 182 ejemplares, de los cuales 146 son vipéridos y 36 elápidos. Cada ejemplar tiene un código alfanumérico que actúa como código de identificación. Los adultos de las especies que alcanzan un gran tamaño corporal llevan implantado un chip del tamaño de un grano de arroz que proporciona un código alfanumérico. El entorno cautivo mantiene condiciones físicas estables (temperatura: 26 ± 0,2 C; humedad relativa 65 ± 5 humedad relativa).
Sin embargo, debido al área del serpentario, la humedad relativa y la temperatura no son homogéneas en todo el recinto. Hay zonas más húmedas y otras más secas, así como zonas relativamente más cálidas y otras menos cálidas. Por lo tanto, aprovechando esta variabilidad, los encierros de las serpientes se organizan en función de la humedad relativa y la temperatura del hábitat original de las serpientes. Por ejemplo, los recintos de
Crotalus durissus están en las zonas más secas del serpentario, mientras que los recintos de
Micrurus surinamensis están en las secciones húmedas. Además, en el interior de los encierros la humedad relativa y la temperatura varían, lo que indica que las cajas de polipropileno proporcionan un microclima. (Tabla 6).
| Especie |
Humedad relativa |
Temperatura |
|
Crotalus durissus |
60,5 (42,3-75,3) |
26,6 (25,5-27,8) |
|
Bothriechis schlegelii |
87,0 (78,1-93,9) |
26,3 (25,2-27,5) |
|
Bothrops asper |
62,5 (42,2-81,9) |
25,6 (25,0-27,2) |
|
Bothrops atrox |
77,1 (45,2-96,9) |
26,4 (42,3-75,3) |
|
Lachesis acrochorda |
64,6 (43,1-84,1) |
25,1 (23,7-28,9) |
|
Micrurus surinamensis |
93,9 (73,4-100) |
25,4 (24,5-26,4) |
Encierros.— Las serpientes se alojan en cajas individuales de polipropileno translúcido de tamaños variados (20 cm de largo x 15 cm de ancho y 20 cm de alto, utilizadas para serpientes con una longitud inferior a 30 cm de longitud rostro-cloaca (LRC); hasta cajas de 60 cm de largo x 40 cm de ancho y 35 cm de alto, utilizadas para víboras grandes como las serpientes de los géneros
Bothrops y
Crotalus de hasta 2 m (LRC). Las ventajas son la seguridad, la facilidad de limpieza y el mantenimiento. De esta manera, las cajas se pueden supervisar fácilmente durante la alimentación y revisión médica. En casos especiales de serpientes de gran tamaño como las especies del género
Lachesis, el tamaño de los encierros es de 100 cm de largo x 45 cm de ancho y 35 cm de alto, construidos con estantes de acero inoxidable y paredes rígidas de acrílico translúcido.
Sustrato.— El sustrato que cubre el suelo de la caja debe cumplir con cuatro criterios: (1) brindar comodidad a la serpiente; (2) ayudar a mantener las condiciones de humedad en el encierro; (3) facilitar la limpieza del encierro; y (4) ser lo suficientemente profundo como para permitir que las serpientes con hábitos semifosoriales se escondan. Para ello, se emplea una mezcla 1:1 de virutas (virutas de álamo) y vermiculita inerte y desinfectada (mineral filosilicato hidratado), la cual llena el suelo de la caja con una profundidad de 2 cm, generando un lecho que permite mantener la humedad relativa de aproximadamente al 70%. En el caso de serpientes semifosoriales, el suelo de la caja se llena hasta una profundidad de 5 cm. No se recomienda el uso de otros sustratos como tierra natural, hojarasca natural o aserrín, ya que son fuentes comunes de patógenos y son difíciles de desinfectar. A diferencia de todas las demás especies alojadas en el serpentario,
Crotalus durissus requiere un microhábitat seco, por lo que, además de colocar el recinto en la zona más seca del serpentario, se utiliza cartón corrugado como sustituto de la vermiculita, garantizando una baja humedad relativa dentro del encierro.
Suministro de agua.— Los encierros de serpientes adultas cuentan con un bebedero plástico circular de 15 cm de diámetro y 10 cm de altura, mientras que los recintos de juveniles o neonatos tienen vasos plásticos desechables de 5 onzas empotrados en el sustrato y sujetos al suelo del encierro. El agua se administra
ad libitum y se cambia cada quince días; sin embargo, este intervalo puede disminuir dependiendo de si se ensucia debido a la defecación o al sustrato.
Ornamentación del encierro.— La disposición de la ornamentación dentro de los encierros, además de proporcionar un ambiente similar al hábitat natural, debe permitir el manejo seguro del personal del serpentario, reduciendo siempre el riesgo de mordeduras durante los procedimientos rutinarios de limpieza, alimentación y ordeño. Por lo tanto, los elementos de ornamentación en los recintos son los mínimos necesarios según la historia natural de las serpientes. Por ejemplo, el recipiente de agua de plástico funciona como refugio para corales, neonatos y juveniles de especies de vipéridos. Además del sustrato mixto de vermiculita y el recipiente plástico de agua, en los encierros de especies arbóreas como
Bothriechis schlegelii o
Bothrops bilineatus se enriquece con ramas de árboles higienizadas asignadas a cada espécimen, de tal manera que cada serpiente utilice siempre el mismo juego de ramas, evitando contaminación cruzada.
En el caso de serpientes muy grandes (más de 2 m LRC) como las de la especie
Lachesis, la experiencia nos ha enseñado que los encierros con objetos caídos ayudan en el proceso de muda de piel para este tipo de serpiente. Por lo tanto, los recintos se enriquecen con troncos de madera pesados, los cuales se rocían con agua diariamente. Tanto los elementos que funcionan como refugios, así como las ramas de los árboles deben colocarse estratégicamente para permitir que la serpiente se sienta oculta, pero permaneciendo visible para el personal del serpentario.
Las serpientes de cascabel son una de las especies más representativas del serpentario del INS, ya que son las exhiben el mayor tiempo medio de supervivencia (9,7 años) entre todas las especies alojadas en el serpentario. Además, han sido las más numerosas históricamente en el serpentario (54 especímenes). A diferencia de las demás especies de serpientes, en los encierros de
Crotalus durissus no se utilizan elementos para enriquecer el entorno en cautiverio. Los únicos elementos dentro de su encierro son una lámina de cartón corrugado y un recipiente de plástico para el agua. La inclusión de elementos que acumulan humedad (p. ej., vermiculita, troncos de madera o refugios de plástico) se ha asociado con patologías como micosis y disecdisis. Por tanto, este es un ejemplo que ilustra que no todas las serpientes requieren un enriquecimiento ambiental complejo, algunas especies necesitan sólo unos pocos elementos para adaptarse al cautiverio y gozar de bienestar.
4.4 Lección cuatro: supervivientes inesperados
Numerosas serpientes alojadas en el serpentario del INS fueron donadas por las Corporaciones Autónomas Regionales (CARs) de Colombia, la policía ambiental, el cuerpo de bomberos; obtenidas a través de rescates, confiscaciones o decomisos. En varios casos, el manejo previo y las condiciones de cautiverio de las serpientes fueron inadecuadas, causando efectos deletéreos en la condición física inicial de la serpiente antes de su ingreso al serpentario. Como consecuencia, algunas de estas serpientes presentaron patologías que afectaron significativamente su supervivencia. Sin embargo, existen casos destacados de serpientes lesionadas que sobrevivieron durante mucho tiempo, a pesar de graves heridas o patologías. Esta lección ilustra los eventos más relevantes de las serpientes sobrevivientes de procedimientos de manejo inadecuados, y que, de forma inesperada, mostraron una recuperación excepcional enseñándonos que, a pesar de las condiciones precarias de salud de algunas serpientes, la voluntad de vivir nunca se rinde.
Caso 1: Micrurus dumerilii INSV-SR-109
Condición de salud de la serpiente durante el ingreso.— Una serpiente hembra adulta (LRC: 680 mm; LC: 65 mm; peso: 59,8 g) proveniente de Viotá, Cundinamarca, Colombia, ingresó en julio de 2016 presentando una lesión musculoesquelética en el primer tercio del cuerpo, mostrando una herida en la piel con una depresión cóncava posiblemente causada por aplastamiento o por un golpe con objeto contundente, provocando ataxia y limitando los movimientos serpenteantes naturales del cuerpo posteriores al golpe. La serpiente permaneció en posiciones anatómicas anormales en el encierro, invirtiendo la posición del cuerpo (superficie ventral del cuerpo visible desde arriba) después de la lesión; sin mostrar comportamientos normales como esconderse en el sustrato.
Consideraciones veterinarias en el manejo en cautiverio.— Un mes después del ingreso, la serpiente presentó pérdida de peso (normal al principio de la cautividad). En la zona de la lesión, se observó una estructura similar a una costilla sobresaliendo de la piel, exhibiendo necrosis alrededor de la herida. De acuerdo con los criterios del médico veterinario, la serpiente fue mantenida bajo observación, no se le administró alimento, pero se proporcionó agua
ad libitum. No se realizó ningún procedimiento médico adicional.
En el segundo mes de cautiverio, se observó una coloración amarilla en la costilla (hueso de costilla no viable) sobresaliendo de la piel, mostrando una evidente retención de piel en la zona de la herida. La piel retenida fue eliminada manualmente y se retiró la costilla. Se aplicó clotrimazol tópico, y la serpiente fue devuelta a su encierro sin evidencia de mejora en la movilidad corporal posterior a la herida.
Durante el tercer mes de cautiverio (octubre), la serpiente fue incorporada al esquema de producción, realizando procedimientos de restricción, manejo, extracción de veneno y alimentación forzada con fórmula nutritiva. En este punto, la serpiente había perdido el 36,8% de su peso inicial (peso: 43 g).
En los meses siguientes, la serpiente regurgitó, rechazando la fórmula nutritiva en varias ocasiones, causando una pérdida dramática de peso hasta el octavo mes. En el noveno mes recuperó peso, mostrando los primeros signos de aceptación de la fórmula nutritiva; recuperando la salud y la condición corporal. En mayo de 2017 alcanzó el peso de ingreso (décimo mes).
En los siguientes cinco meses, el peso y la salud de la serpiente se recuperaron, aceptó totalmente la alimentación forzada con fórmula nutritiva, y mostró una buena adaptación cautiverio. La herida sanó sin necesidad de tratamiento médico o intervención, dejando una cicatriz marcada en la zona de la lesión. Sin embargo, la ataxia continuó sin mejoría, limitando el comportamiento normal en el encierro; la serpiente fue incapaz de esconderse en el sustrato o refugios artificiales. Debido a la lesión, la muda normal fue obstaculizada, siendo necesario que los cuidadores le ayudaran en el proceso de muda.
Adaptación, supervivencia y expectativa de vida.— Debido a la gravedad de las lesiones, el diagnóstico inicial fue negativo. Además, según la experiencia acumulada con especies de
Micrurus en cautiverio, la esperanza de vida prevista era inferior a dos meses, lo que podría haber disminuido aún más después de la intervención veterinaria que desprendió la costilla. Sin embargo, en contra de todas las expectativas, la serpiente vivió durante seis años (hasta el 22 de junio de 2022) e hizo parte del esquema de producción, así como de las actividades rutinarias de extracción de veneno y alimentación.
En el momento de su fallecimiento, la necropsia no proporcionó una causa concluyente de la muerte. Sin embargo, durante los últimos diez meses antes de la muerte, la serpiente mostró un deterioro de la salud, exhibiendo pérdida de peso y retención de la muda en todo el cuerpo, así como una inmovilidad general progresiva, signos claros de envejecimiento en reptiles geriátricos
[45].
Caso 2: Micrurus dumerilii INSV-SR-113
Condición de salud de la serpiente durante el ingreso.— Una serpiente hembra adulta (LRC: 690 mm; LC: 82 mm; peso: 60,3 g) proveniente de San Onofre, Sucre, Colombia, ingresó el 17 de septiembre de 2017, presentando buenas condiciones de salud.
Consideraciones veterinarias en el manejo en cautiverio.— Un mes después del ingreso, la serpiente presentó pérdida de peso (normal al comienzo de la cautividad), mostrando opacidad en las escamas internasales y parietales. Sin embargo, se había observado una muda completa durante el primer mes de cautiverio, por lo que parecía improbable que la opacidad fuera debido a la retención de la muda. En los meses siguientes, la serpiente mostró signos del síndrome de mal adaptación, como rechazo de la fórmula nutritiva (regurgitación), mudas excesivas (dos eventos de muda por mes), pérdida de peso, y opacidad en las escamas de la cefálicas y dorsales.
Dado que el síndrome de mal adaptación persistía, a pesar de los riesgos de generar retención de la muda, se realizó alimentación forzada con fórmula nutritiva durante la muda para intentar detener la pérdida de peso y la condición corporal deprimida de la serpiente. La opacidad en las escamas cefálicas y dorsales se trató clínicamente como una infección micótica; sin embargo, el tratamiento no tuvo efecto. Así, la opacidad de las escamas se convirtió en una condición crónica de la serpiente. En cada evento de muda la serpiente tuvo que ser asistida por los cuidadores. Esta técnica de manejo en cautiverio se mantuvo durante mucho tiempo. Se logró detener la pérdida de peso y la condición corporal deprimida de la serpiente, pero las mudas excesivas y opacidad de las escamas fueron crónicos.
Adaptación, supervivencia y expectativa de vida.— Este caso ejemplifica cómo una serpiente que ingresó al serpentario con buenas condiciones de salud y diagnóstico veterinario desarrolló rápidamente un síndrome de mal adaptación que amenazó su supervivencia. Sin embargo, gracias a la atención veterinaria y el manejo adecuado, esta trayectoria fue revertida, prolongando su esperanza de vida, a pesar de que la serpiente nunca se adaptó adecuadamente al cautiverio. La serpiente vivió cuatro años en cautiverio y fue incluida en el esquema de producción rutinaria del serpentario del INS hasta su muerte, aunque no se observaron otros signos o patologías.
Apéndice: Métodos
Con base en las historias clínicas disponibles desde 1990 hasta 2021 de las serpientes alojadas en el serpentario del Instituto Nacional de Salud de Colombia para la producción de antiofídicos, describimos, analizamos los datos más destacados y casos especiales. Además, para evaluar la probabilidad de supervivencia de las serpientes en cautiverio y las variables asociadas realizamos un análisis de supervivencia estándar a través del estimador de Kaplan-Meier y modelos de Cox PH (considerando covariables constantes)
[46,47]. Todos los análisis se realizaron utilizando el software Rwizard 4.3
[48] y el paquete “survival” en lenguaje R
[49].
La alimentación con fórmula nutritiva, así como el enriquecimiento del encierro mediante la incorporación de vermiculita como componente del sustrato, fueron aportes del biólogo Jairo Maldonado, quien durante su vinculación al INS contribuyó con su experiencia en el manejo, mantenimiento y bienestar de las serpientes coral. A partir de sus observaciones y recomendaciones, el equipo técnico del serpentario del INS ha ajustado y perfeccionado estas prácticas.